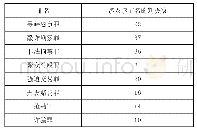
《表2 i OPCs生成所涉及主要重编程因子的作用机理及功能》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《介导诱导性少突胶质细胞祖细胞生成的重编程因子的研究进展》
SHH:音猥因子;FGF:成纤维细胞生长因子;PDGF-AA:血小板源生长因子AA;MCS:多物种保守序列;SMAD:Sma和Mad同源物;GSK-3β:糖原合成酶激酶-3β;RA:维甲酸;RARE:RA应答元件;PMP22:外周髓鞘蛋白;STK:丝氨酸/苏氨酸蛋白激酶;Fox J3:叉头框J3;Erk1/2:细胞外信号调节激酶1/2;PI3K:磷脂酰
但是,目前i OPCs的生成和应用仍存在一些问题有待解决:(1)利用重编程技术生成功能性i OPCs的效率整体较低,仅有25%左右;(2)i OPCs在体外培养周期较长,增加了基因突变的风险,而且,生成的i OPCs中通常还混杂有神经细胞,不适用于细胞的移植治疗;(3)鉴定i OPCs分化阶段的技术比较单一,大多依赖于细胞表面抗原的表达;(4)在体内损伤微环境中,如何实现i OPCs的高效增殖和定向分化?(5)如何促进i OPCs来源OLs的体内成熟和功能化?(6)在过表达Olig 2、Sox 10、Nkx 6.2以及mi RNA等重编程因子时,大多采用了病毒载体介导i OPCs的生成,存在较为严重的生物安全隐患,限制了其在临床中的应用。最近Kantawong等[75]采用由明胶、纳米羟基磷灰石(nano-hydroxyapatite,Nano-HA)和猪脑提取物制成的生物材料,在无病毒载体介导重编程因子表达、不添加特殊化学诱导剂的情况下,实现了NIH/3T3细胞向神经谱系细胞i NSCs的转化,后者可以进一步分化成为OLs,这为修复髓鞘缺失提供了新思路。因此,在未来的研究中,需要进一步探讨重编程因子的功能和作用机制(表2),优化重编程因子的组合,特别是探寻完全基于小分子物质的谱系转化方法,提高非病毒载体介导的重编程效率,加大i OPCs体内移植后的微环境影响、分化过程跟踪和功能研究等,为脱髓鞘疾病的再生治疗提供更为安全、高效的新策略。
| 图表编号 | XD0096091800 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.08.01 |
| 作者 | 令文慧、王明玉、熊春霞、谢登峰、陈麒宇、褚新月、李云鑫、邱小燕、李跃民、肖雄 |
| 绘制单位 | 西南大学动物科技学院、西南大学动物科技学院、西南大学动物科技学院、西南大学动物科技学院、西南大学动物科技学院、西南大学动物科技学院、西南大学动物科技学院、西南大学动物科技学院、西南大学动物科技学院、西南大学动物科技学院 |
| 更多格式 | 高清、无水印(增值服务) |