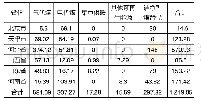
《表1 截至2017年底完成审评建议批准上市的优先审评药品分类》
根据《2016年度药品审评报告》[11]和《2017年度药品审评报告》[12],截至2017年底,共有110种药品注册申请通过优先审评程序得以加快批准上市(以通用名计算,共涉及56个品种)。根据国家食品药品监督管理总局药品审评中心(CDE)网站(www.cde.org.cn)“信息公开”版报下的“优先审评公示”专栏,上述56种药品按照纳入优先审评的理由分为6类,详见表1(注:表中首仿药是指国内首先仿制生产并上市销售的仿制药品;同步申报药是指申请人在美国、欧盟同步申请并获准开展药物临床试验的新药,下同)。
| 图表编号 | XD0083212400 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.08.30 |
| 作者 | 沈洁、蒋蓉、邵蓉 |
| 绘制单位 | 中国药科大学国家药物政策与医药产业经济研究中心、中国药科大学国家药物政策与医药产业经济研究中心、中国药科大学国家药物政策与医药产业经济研究中心 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式