《表2 以符合儿童用药为由被纳入优先审评审批名单的80项药品注册申请》
数据来源:NMPA,截至 2019 年 4 月 8 日
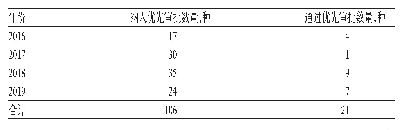
儿童用药在全球均是一个未被满足的临床需求,其中包括儿童专用药和在药品说明书中标明儿童用药信息的药品。为了保障儿童用药的基本需求、安全性和科学合理性,我国近年发布了多项促进研发创制儿童药品的法规政策。原国家卫生和计划生育委员会等六部委早在2014年5月21日发布了《关于保障儿童用药的若干意见》(国卫药政发[2014]29号)[1]。为了促进儿童药物适宜品种、剂型、规格的研发创制和申报审评,以及满足儿科临床用药需求,国家卫生健康委员会、工业和信息化部、国家药品监督管理局(NMPA)发布了3批鼓励研发申报儿童药品清单,最新一批于2019年7月22日发布,即《第三批鼓励研发申报儿童药品清单》(国卫办药政函[2019]642号)[2]。原国家食品药品监督管理总局(CFDA)曾于2017年12月28日发布《关于鼓励药品创新实行优先审评审批的意见》(食药监药化管[2017]126号)[3],明确列出优先审评审批的药品注册申请范围,其中范围(二)第6条即为儿童用药品(见表1);截至2019年4月8日,一共有827项药物注册申请被纳入优先审评审批名单,其中80项药物注册申请的纳入依据是儿童用药(见表2)。获取相关政策红利,或可成为儿童药物研发企业的致胜关键。
| 图表编号 | XD00113427800 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.09.25 |
| 作者 | 萧凤鸣 |
| 绘制单位 | 英富曼集团医药情报部 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式