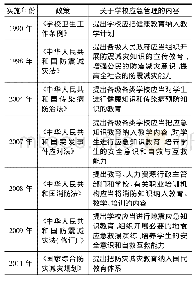
《表1 EUA获批条件:突发公共卫生事件相关的药品审评审批政策思考》
从表2可知从2005年至今共针对10种紧急情况进行了EUA的签发,10种紧急情况均为重大突发公共卫生事件,8种为生物威胁,1种是化学威胁,1种是军事用途。该信息仅显示了2005年至今的时间段,未体现与我国2003年爆发的SARS病毒相关的EUA信息。共签发了65种EUA,其中体外诊断为57种(占87.7%),另外包括7种药物及生物制品,1种防护设备。获得EUA授权的7种药物及生物制品,多为已获批上市的产品,通过给予EUA以扩大受试范围(例如扩大适应症、扩大使用人群、增加给药强度等),并且EUA产品的分发和使用可根据需要另行规定。
| 图表编号 | XD00126613300 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.03.08 |
| 作者 | 孙昱 |
| 绘制单位 | 国家药品监督管理局药品审评中心 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式