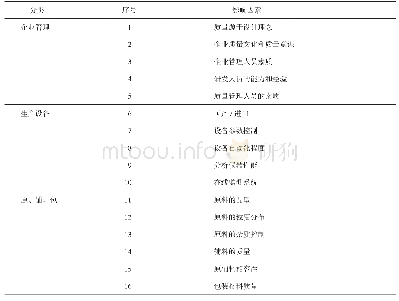
《表3 欧盟仿制药上市审评程序》
欧盟发布的指令2001/83/EC是一项综合性指令,里面规定了仿制药的上市条件与程序,与参比制剂相比,具有相同有效成分、剂型和生物等效性的药物均为仿制药[7]。仿制药可用“简化注册”申请,此外还对参比制剂的选择进行了规范与指导,参比制剂应该是已经批准在欧盟或其有关成员国上市8年以上的药品且有完整的全套的申报资料[8]。介于欧盟是多成员国组成,目前并没有唯一的审评程序与统一的参比制剂目录,根据审评方式的不同可以选择不同的参比制剂。首先欧盟药品的审批程序有4种:集中审评、非集中审评、互认审评与成员国审评,非集中审评与互认审评之间的区别在于,前者的产品未在任何成员国上市销售,后者是已经在一个或数个成员国上市后再在其他相关成员国上市。而仿制药相对而言要少一种上市程序(表3),其审评程序的选择与原研药采取的上市审评程序有关,例如如果仿制药计划采取集中审评的方式申请上市,那么只有在原研药品上市时也采取集中审评程序才有可能。仿制药不同的上市审评程序所选择的参比制剂目录也有所不同,根据审评程序的不同可以在相应的联盟注册目录、互认审评程序产品目录与欧盟成员国产品目录上寻找适合的参比制剂进行研究[9]。
| 图表编号 | XD00199147300 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.10.28 |
| 作者 | 胡宇、宗欣、于淼、李勇 |
| 绘制单位 | 中国药科大学国际医药商学院、国家药品监督管理局信息中心、国家药品监督管理局信息中心、中国药科大学国际医药商学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式