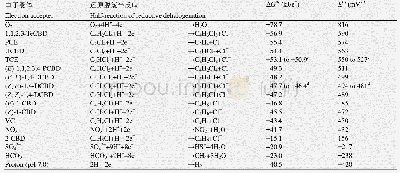
《表3 化合物29和11与INSTIs蛋白的复合物在分子动力学过程中的结合自由能》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《HIV-1整合酶链转移抑制剂的3D-QSAR、分子对接和分子动力学模拟研究》
为了进一步阐述复合物体系的稳定性,本文利用MM-PBSA方法计算复合物体系的结合自由能。截取复合物体系在分子动力学模拟的14~20 ns相对稳定状态区间,在每100ps时截取200个快照。得到的复合物体系的不同能量贡献值见表3,结合自由能越低说明复合物体系越稳定。从图中发现,化合物29的自由结合能明显比化合物11的低,说明化合物29的复合物体系更加稳定。这与之前得出的实验数据是相一致的。同时还可以看到,范德华相互作用贡献比其他的能量的贡献更大,说明范德华力对于结合自由能有着重要作用,也提示疏水作用对抑制剂与INSTIs蛋白复合物的稳定性起着关键作用。
| 图表编号 | XD0066047100 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.07.18 |
| 作者 | 刘冬琳、刘鹰翔、李耿、马玉卓、曾巧玲 |
| 绘制单位 | 广州中医药大学中药学院、广州中医药大学中药学院、广州中医药大学中药学院、广东药科大学药学院、广州中医药大学中药学院 |
| 更多格式 | 高清、无水印(增值服务) |