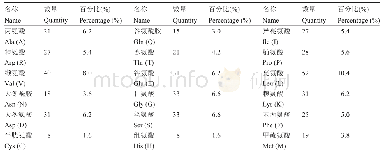
《表1 P1位点氨基酸残基与其对应抑制的蛋白酶种类》
注:除了P1位点的氨基酸残基为His和Pro时,枯草杆菌蛋白酶均被广泛的PI抑制。
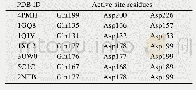
KaPI的作用原理也是符合Laskowski机制,当KaPI与蛋白酶作用时,P1位点的氨基酸残基的侧链可完全契入蛋白酶活性位点(也称为S1腔)内,同时分子中Kazal结构域共有12个接触位点(分别为P6、P5、P4、P3、P2、P1、P1′、P2′、P3′、P14′、P15′以及P18′)可与蛋白酶接触。抑制剂分子通过非共价键与蛋白酶形成“蛋白酶-KaPI”复合物,并且两者之间的缔合系数非常高,导致KaPI对蛋白酶的抑制作用非常强烈和紧密,另一个方面,KaPI分子对蛋白酶抑制特异性主要是由B环上的P1位点(位于第二个半胱氨酸残基后的第二个氨基酸位置上[46])的氨基酸残基决定(如表1),而其它11个与蛋白酶接触氨基酸残基会有效影响结合效力以及抑制活力。
| 图表编号 | XD0057491100 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.05.20 |
| 作者 | 张允萍、吴子健、李丹阳 |
| 绘制单位 | 天津商业大学生物技术与食品科学学院天津市食品生物技术重点实验室、天津商业大学生物技术与食品科学学院天津市食品生物技术重点实验室、天津商业大学生物技术与食品科学学院天津市食品生物技术重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式