《表3 各国数据保护情况:药品研发过程中的知识产权制度及运用》
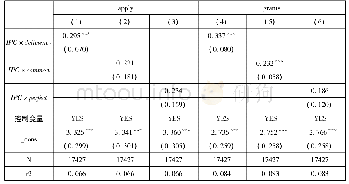
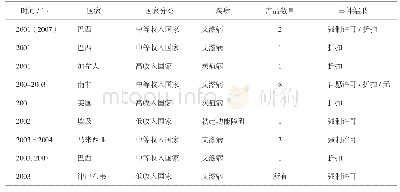
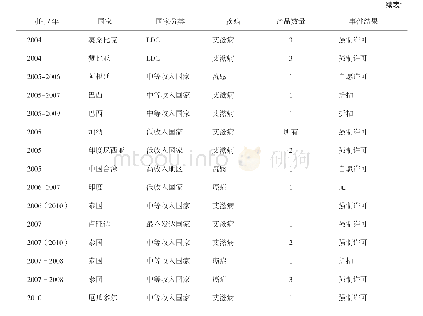
数据保护制度强调“不依赖”(该制度独有的核心义务,通过“不受理”/“不批准”来履行)和“不披露”(涉及保密的一般义务),可作为专利保护的一种补充:若没有专利保护,药物可被第三方抢先申请注册而造成巨大研发投入无法收回的局面;若没有数据保护,他人在产品上市专利到期后,可进行仿制,而造成市场份额的冲击。该制度意在独占性保护“药品未批露的试验数据或其他数据”,主要包括用以证明药品安全、有效的临床试验数据等。首个新药申请人在注册申报时就需要提交数据保护申请,而FDA对在数据独占期内的仿制药申请是不予受理的,说明数据独占较市场独占更为强势,以防止不正当的商业使用。例如拜耳公司的抗癌药紫杉醇,虽未布局专利保护,但其通过数据保护仍获得了每年高达11亿美元的销售收入[9]。再如抗癫痫药拉莫三嗪的专利到期日早于数据保护到期日,但是GSK公司进行二次开发后,扩大了拉莫三嗪的新适应证并提交了儿科临床试验数据,由此延长保护时限,进一步延缓了仿制药厂商拉莫三嗪产品的上市[10]。值得注意的是,通过提交自己全套数据的第二个申请销售许可的人,不受数据保护制度约束,表示该保护并未赋予药品信息以独占性,由此鼓励国内企业自行提交药品研究数据。美国、欧洲、日本、澳大利亚、加拿大以及中国的数据保护情况见表3,其中各保护期以首次获得批准许可之日起计。
| 图表编号 | XD0049343600 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.01.15 |
| 作者 | 黄璐、余浩、张长春、刘哲、何文、钱丽娜 |
| 绘制单位 | 武汉大学药学院、上海弼兴律师事务所、武汉智权专利代理事务所、武汉光谷生物产业基地建设投资有限公司、人福医药集团股份有限公司、武汉大学药学院、武汉朗来科技发展有限公司 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式