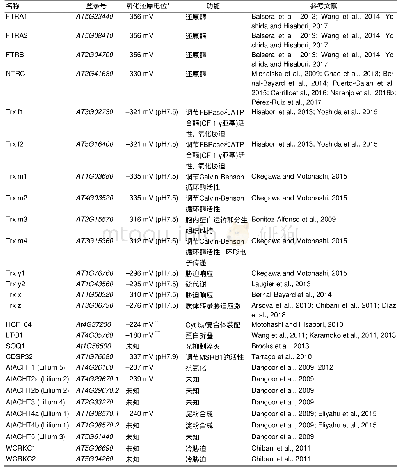
《表1 拟南芥叶绿体Trx系统》
*无特殊说明即表示p H=7.0;**可溶性蛋白的116–261位氨基酸残基;***可溶性蛋白的231–376位氨基酸残基。*Unless specific notification,it means p H=7.0;**Amino acid residues(116–261)of soluble protein;***Amino acid residues(231–376)of soluble protein.
Trx蛋白表面电荷分布及氧化还原电位(Em)的差异决定了它们的生化特性不同(表1)。Trx f、Trx m、Trx x和Trx y都可以通过还原2-Cys Prx参与抗氧化代谢(Pulido et al.,2010);Trx f和Trx m能够还原FBPase以及柠檬酸循环中的苹果酸脱氢酶(NADP-malate dehydrogenase,NADP-MDH)(Née et al.,2009;Okegawa and Motohashi,2015) ,其中Trx f为主要还原剂,Trx m次之;Trx m3参与胞内蛋白质运输和分生组织维持(Benitez-Alfonso et al.,2009);Trx m4影响环式电子传递(Courteille et al.,2013)。Trx m1、Trx m2和Trx m4共同作用于光系统II(photosystem II,PSII)的生物发生(Wang et al.,2013)。Trx x通过作用于2-Cys Prx参与胁迫响应(Bernal-Bayard et al.,2014)。Trx y2通过调控甲硫氨酸亚砜还原酶(methionine sulfoxide reductase,MSR)的活性参与高光条件下的硫代谢(Laugier et al.,2013);Trx z通过调控质体编码的RNA聚合酶(plastid-encoded RNA polymerase,PEP)参与质体转录(Arsova et al.,2010;Chibani et al.,2011;Díaz et al.,2018)。此外,叶绿体基质还含有CDSP32(Cain et al.,2009;Tarrago et al.,2010)、6种非典型性半胱氨酸和组氨酸富含型(atypical Cys His-rich Trx,ACHT)(Dangoor et al.,2009,2012;Eliyahu et al.,2015)及2种非典型性WCRKC型蛋白(Chibani et al.,2012)。它们均属于Trx类似蛋白,在活性位点上含有非典型氧化还原活性基序。其中,CDSP32受干旱和高光诱导,并可调节MSRB1的活性(Tarrago et al.,2010)。ACHT1蛋白在光照下处于还原态,可还原2-Cys Prx,但电子供体未被鉴定(Dangoor et al.,2012)。ACHT4除了可以还原2-Cys Prx外,还直接为腺苷二磷酸葡萄糖焦磷酸化酶(ADP-glucose pyrophosphorylase,AGPase)的小亚基ASP1提供电子(Eliyahu et al.,2015)。除了可溶性Trx之外,叶绿体含有与类囊体结合的更高分子量的Trx类似蛋白(HCF164、LOT1和SOQ1)(Motohashi and Hisabori,2010;Karamoko et al.,2011;Brooks et al.,2013) 。它们在自身的氧化还原活性位点序列上存在修饰,控制着类囊体膜与腔蛋白的氧化还原状态。此外,生物信息学预测表明,还有一些假定的Trx类似蛋白定位于类囊体膜上(plastid proteome database,PPDB),但功能未知。
| 图表编号 | XD0049128900 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.01.10 |
| 作者 | 秦童、黄震、康振辉 |
| 绘制单位 | 四川理工学院生物工程学院、四川大学生命科学学院生物资源与生态环境教育部重点实验室、四川大学生命科学学院生物资源与生态环境教育部重点实验室、四川理工学院生物工程学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式

![表1 Trx G复合物成分[23]](http://bookimg.mtoou.info/tubiao/gif/ZGXM202011002_00800.gif)