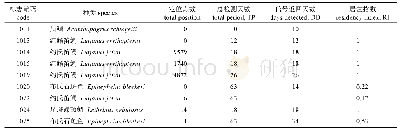
《表3 GMP跟踪检查企业停产情况Tab.3 The Discontinued Result in the Tracking Inspection of GMP》
3.4 药品生产监督管理办法规定药品生产企业质量负责人、生产负责人发生变更应报所在地省、自治区、直辖市(食品)药品监督管理部门备案。本轮跟踪检查药品生产企业涉及关键人员变更的15家企业、涉及委托检验的24家企业都能按法规要求进行备案,说明企业在这两方面的备案都做得很好,符合法规和GMP的要求。但跟踪检查发现企业在停产备案方面的工作还是做得不够好,大部分企业停产的剂型范围未能及时向监管部门备案,停产未进行备案可能存在一定风险:一是监管部门未能对企业停产期间人员变更、厂房、设施设备是否进行有效维护和保养进行监督;二是企业在恢复生产时有可能存在未进行确认和验证就直接生产的情况,导致不合格产品出现。为消除这一风险,药品监管部门可以加强对企业的宣传,引导企业在停产时积极向监管部门进行备案,另一方面省级监管部门也可以根据国家法律法规制定地方性文件加强对企业停产备案的管理,使企业符合GMP要求,确保药品质量安全。2017年国家卫生和计划生育委员会关于《改革完善短缺药品供应保障机制》的实施意见强调药品生产企业停产备案制度可以有效完善短缺药品监测预警和清单管理工作,实现药品供应保障综合管理和短缺监测预警信息资源的共享共用,形成具有中国特色的短缺药品供应保障制度,实行短缺药品供应保障分类精准施策。
| 图表编号 | XD0048019600 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.01.10 |
| 作者 | 陆仕华、韦莹莹、李杉、韦广辉 |
| 绘制单位 | 广西壮族自治区食品药品审评查验中心、广西壮族自治区食品药品审评查验中心、广西壮族自治区食品药品审评查验中心、广西壮族自治区食品药品审评查验中心 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式