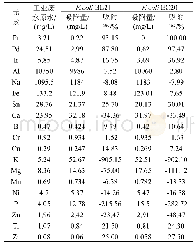
《表2 Y.lipolytica和E.coli中基因表达活性情况汇总表》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《解脂耶氏酵母表面展示β-淀粉酶与α-葡萄糖转苷酶及一步法由淀粉合成低聚异麦芽糖》
(+) :active;(–):inactive.
本研究将合成低聚异麦芽糖的两种关键酶β-淀粉酶基因与α-葡萄糖苷酶基因进行融合,在Y.lipolytica中进行表面展示表达以及在E.coli中进行胞内表达。有趣的是,融合基因在酵母表面展示表达时,基因的不同融合顺序对酶的活性具有很大的差异。当以β-amylase-GTase的先后顺序进行融合表达时,两种酶均有活性;而当以GTase-β-amylase的先后顺序在酵母表面进行融合表达时,均未发现有催化活性。然而,当融合基因在大肠杆菌进行胞内融合表达时,无论以哪种融合顺序(GTase-β-amylase或β-amylase-GTase),发现β-amylase均有催化活性,而GTase均无活性(表2)。造成这种酶活性因融合顺序不同而不同的原因,很可能是融合顺序影响了GTase的正确折叠。无论是GTase-β-amylase或β-amylaseGTase融合方式,在大肠杆菌中GTase均不能正确折叠,即使能够表达也没有活性。而β-amylase能够正确折叠,从而在这两种不同的融合方式中均表现出活性。因此,在进行酶融合表达研究时,需要对不同的融合顺序研究,以确定最佳的融合方式。
| 图表编号 | XD0040385400 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.01.25 |
| 作者 | 刘大文、程海荣、邓子新 |
| 绘制单位 | 上海交通大学生命科学技术学院微生物代谢国家重点实验室、上海交通大学生命科学技术学院微生物代谢国家重点实验室、上海交通大学生命科学技术学院微生物代谢国家重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |