《表4 日本PMDA将再生医学治疗产品按照风险分类举例[20]》
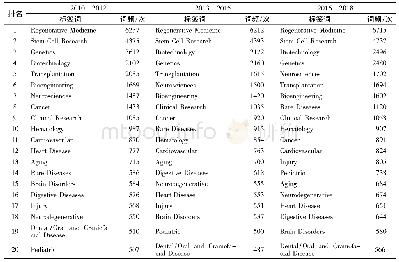
干细胞治疗产品监管方面,日本位于亚洲前列2014年9月,日本RIKEN研究所完成了世界首例自体iPS来源的视网膜色素上皮细胞移植治疗黄斑变性[19]并于2017年完成了首例iPS细胞的异体移植.根据日本法规,“再生医学产品”包括可用于预防或治疗疾病的可重构、修复人体结构和功能的细胞或基因治疗方法.这个概念与欧盟的先进治疗医学产品(ATMPs)类似.日本将再生医学产品作为第三类产品(非药物和医疗器械)单独管理,由专门的细胞和组织产品办公室(office of cellular and tissue-based products)审评,干细胞临床试验计划通过伦理委员会,经厚生劳动省(ministry of health,labor and welfare,MHLW)审评通过方可进行.目前在日本干细胞临床试验开展较多的为自体骨髓产品、自体外周血产品和自体脂肪组织产品.日本2014年颁布了再生医学促进法案,对药品医疗器械法案(PMD.Act)进行了修改以适应再生医学产品特点,同时颁布了再生医学安全性修订案.再生医学安全修订案将再生医学治疗产品按照风险进行了分类[20],见表4.列为高风险的产品,例如使用iPSC细胞的产品,将递交至MHLW进行为期90天的审评,审评期间MHLW必须就临床试验方案咨询健康科学委员会(health science council).再生医学安全性修订案对未按照药品申报的医院日常细胞治疗临床研究也进行了规定,包括对细胞生产场所和医院内部供者细胞收集、处理、治疗等流程进行了要求.其中规定,每一个细胞生产场所均应告知PMDA或经PMDA批准或认证.在日本境内的医疗机构进行生产的,需要告知PMDA.在日本境内的非医疗机构和境外机构进行生产的,分别需要PMDA认证和批准.细胞生产环境、设备,细胞制备工艺,产品质量控制,检验方法,储存方式均应符合标准要求.MHLW或PMDA将根据细胞治疗实施的具体情况开展现场检查.与美国政策类似,日本也设立了优先审评政策,对治疗危重疾病的再生医学产品设置了有条件有时限批准,只要产品的安全性能够保障且显示初步有效,即可有条件有时限批准上市,方便患者尽早使用.上市后在临床使用过程中需评价和证实产品的有效性和安全性,7年之内再次申请常规审批最终决定是否正式上市或撤市.
| 图表编号 | XD0034728900 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.01.20 |
| 作者 | 卢加琪、刘伯宁、罗建辉 |
| 绘制单位 | 国家药品监督管理局药品审评中心、国家药品监督管理局药品审评中心、国家药品监督管理局药品审评中心 |
| 更多格式 | 高清、无水印(增值服务) |
![《表4 日本PMDA将再生医学治疗产品按照风险分类举例[20]》](http://bookimg.mtoou.info/tubiao/gif/JCXK201901003_40200.gif) 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式