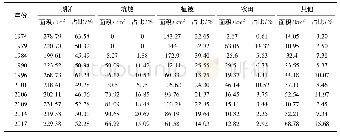
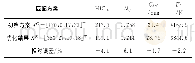《表6 催化剂类型及条件筛选Tab.6 Catalyst screening and optimization of the reaction conditions》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《(R)-BINOL制备的手性磷酸在不对称Mannich反应中的应用》
通过人们对医药分子的研究发现,二氢吡啶(DHPs)具有重要的医药活性,特别是4-芳香基取代的手性二氢吡啶。并在合成此类分子领域取得了显著成就,已有众多的合成方法用于此类分子合成。Jiang等[14]报道了一种利用手性磷酸不对称催化α,β-不饱和醛、胺与β-酮乙酸酯三分子环化的方法,并得到很高的产率和对映选择性(e.e.98%)。其反应机理为:α,β-不饱和醛首先与胺缩合脱水形成1-氮-1,3丁二烯结构,后与烯醇化的β-酮酯亲和加成形成环状中间体,再脱水形成光学活性产物。基于手性磷酸在不对称催化亚胺反应中过渡态以及可能的反应机理的分析;并通过实验验证,增大手性磷酸分子3,3'-位取代基的空间大小,会提高反应的对映选择性(表6,序号1~4),手性磷酸1l显示最好的催化活性;提高反应温度,则同样会增加反应的对映选择性(表6,序号4~6);而反应溶剂以苯甲腈为最好,可得到e.e.89%的选择性;有趣的是减少催化剂的用量却可以提高其选择性,这与以往经验不同。对于芳香胺分子,芳香环上的取代基对反应的产率及对映选择性有一定的影响,由于胺要同不饱和醛缩合,胺作为供电子试剂,所以供电子基显示比较好的活性,吸电子基则对反应不利,实验结果证实了这一推断。另外,酮酯的结构也对反应产生一定的影响,如乙酰乙酸乙酯以及乙酰乙酸异丙酯显示比较好的选择性(e.e.92%),而乙酰乙酸甲酯则选择性较差(e.e.81%)。此反应的不足之处在于,β-烷基取代的不饱和醛显示出比较差的活性,仅对于芳香取代基显示出好的收率和选择性。
| 图表编号 | XD0034377300 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.03.15 |
| 作者 | 杨翠凤、徐泽刚、陈涛、李秉擘、宁斌科 |
| 绘制单位 | 西安近代化学研究所氟氮化工资源高效开发与利用国家重点实验室、西安近代化学研究所氟氮化工资源高效开发与利用国家重点实验室、西安近代化学研究所氟氮化工资源高效开发与利用国家重点实验室、西安近代化学研究所氟氮化工资源高效开发与利用国家重点实验室、西安近代化学研究所氟氮化工资源高效开发与利用国家重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |