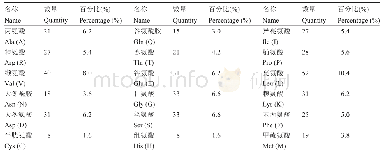
《表1 维生素H周围的链霉亲和素氨基酸残基序列比较》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《Discovery Studio软件在生物化学教学中的应用——分子的刚性对接》
为清晰地了解SA肽链中氨基酸残基与维生素H间的相互作用方式,我们在相互作用二维图中用绿色的圆球表示有范德华力作用的残基;用紫色圆球表示配体周围具有极性、带电荷或能与配体形成分子间的氢键的氨基酸残基;蓝色圆球表示氨基酸残基的溶剂可及表面。通过课程学习,学生已经知道Pugliese等人在1993年时已对生物素-链霉亲和素复合物的晶体结构进行了解析,得到了单个维生素H分子与SA单条肽链结合位点处的相关原子序号与氨基酸残基序列[16](图5 (a)) 。通过测定环绕在维生素H周围的SA单条肽链里的氨基酸残基序列(表1),理论计算比实验测得的结果少了12号天冬酰胺、16号丝氨酸、33号酪氨酸、77号苏氨酸、97号色氨酸和99号亮氨酸,比实验所测结果多了79号苯甲氨酸和99号亮氨酸,但维生素H周围的SA单条肽链里的氨基酸残基序列与实验所测结果大致相同。如果要得到更为准确的配体与受体相互作用处的周围环境,可使用柔性对接的方法,但对接需要的计算资源和时间会大大增加,从而影响课堂教学与课后自学的效率。
| 图表编号 | XD0031121000 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.01.18 |
| 作者 | 侯彦君、蔡开聪 |
| 绘制单位 | 福建师范大学化学与材料学院、福建省理论与计算化学重点实验室、宁德师范学院特色生物化工材料福建省重点实验室、福建师范大学化学与材料学院、福建省理论与计算化学重点实验室、宁德师范学院特色生物化工材料福建省重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |


![表4 亲和素稀释浓度优化实验结果[(±s),A450]](http://bookimg.mtoou.info/tubiao/gif/ZYLN202005008_03300.gif)
