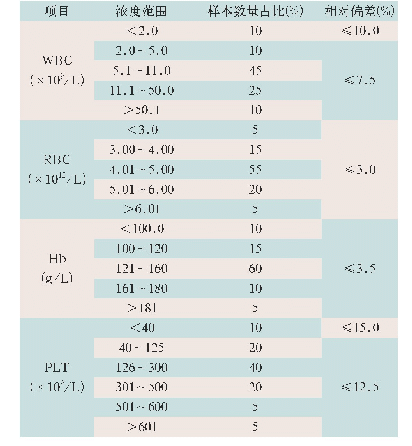
《表1 FDA和NMPA要求验证的交叉反应样本》
FDA表示,如对大量新冠抗体阴性的样本(例如≥75个于2019年12月前在美国收集的样本)进行检测,特异性>95%,则表明试剂对表1中病原体无交叉反应。如果未检测足够数量的样本,或者特异性不足95%,则需要企业详细描述交叉反应试验数据,并且评估表1中物质是否产生交叉反应。如产生,应对每种疾病/感染病原体/抗体亚型进行至少5个样本的试验验证。NMPA主要对病原体的种类进行了明确要求,并未规定各病原体抗体阳性样本的例数。
| 图表编号 | XD00229766600 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.10.10 |
| 作者 | 李红然 |
| 绘制单位 | 国家药品监督管理局医疗器械技术审评中心 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式