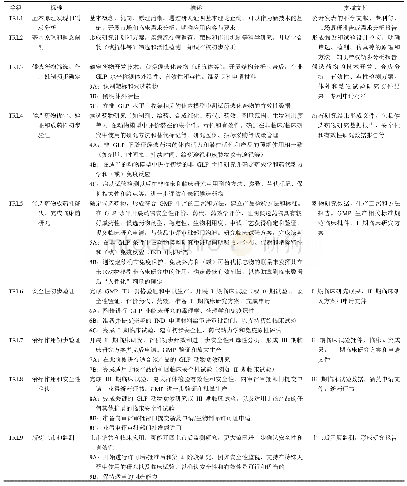
《表2 我国新药创制技术成熟度评价参考等级》
为建立适用我国新药创制实际的技术成熟度评价标准,有效支撑研发创新、科技计划管理、科技成果转化等工作,笔者借鉴美国USAMRMC以及美国卫生和公众服务部新药成熟度评价方法[10],按照我国新药监管部门的政策要求和实际情况,经过专家咨询、调研座谈等方式,制定适合我国国情新药创制专项成熟度评价方法,见表2。该方法主要适用于化学药和生物制品的成熟度评价,突出4项特点:(1)强化适用范围广,结合我国创新药的注册分类及国内外生产质量管理规范存在的差异,制定适用化学药、生物制品的相对通用的评价等级,针对化学药、生物药的具体要求不做详细要求。(2)充分考虑新药创制复杂性,涵盖技术、监管、市场等多方面因素,评价等级包括技术研发、临床应用价值、监管规范、知识产权保护等多种因素。(3)突出研究开发与生产制造相结合。即突出适用科技研发项目,明确针对审评审批的具体要求,需要严格遵守相关法规制度,同时强化GMP生产工艺、验证、批量生产等相关要求,注重研发生产协同评价。(4)注重评价等级实用性,等级标准尽可能明确需开展工作和相关结果,TRL3~TRL9每级下设“ABC”的具体标准,利于管理者和研发人员理解和运用。
| 图表编号 | XD00229766700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.10.10 |
| 作者 | 张春鹏、范宇婷、董红霞 |
| 绘制单位 | 国家科技部科技评估中心、国家科技部科技评估中心、国家科技部科技评估中心 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式





