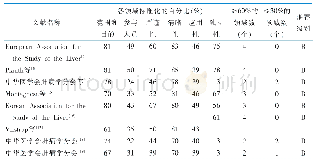
《表1 国外物质平衡临床研究的相关指南与法规》
早在20世纪五六十年代,国外就已有使用放射性同位素技术进行新药人体ADME研究的报道[3-4]。1975年7月,美国食品药品监督管理局(FDA)制定了放射性药物研究委员会计划(RDRC program)[5]。RDRC对放射性药物的质量、受试人群的选择及给药剂量(包括化学剂量和放射性剂量)等都有明确的要求。所有放射性药物的人体临床研究必须得到RDRC的批准后才能开展。1992年,国际辐射防护委员会(ICRP)出台了“生物医药研究中的放射防护规定”,提出了人体辐射暴露的危害,建议研究药物的辐射剂量需小于效用剂量[6]。1998年,美国环境保护署(EPA)在当年颁布的《健康效应检测指南———代谢与药动学》[7]中指出,如果在动物实验中发现特殊毒性相关的代谢产物,或者有显著种属差异的代谢产物,则需要进行人体的物质平衡试验,并推荐使用14C放射标记研究药物,也可以考虑其他标记物。此后,FDA、欧洲药品管理署(EMA)、欧洲工作安全健康署(EASHW)以及国际人用药品注册技术协调会(ICH)都陆续发布了一系列与人体物质平衡研究相关的指南(表1),明确提出“物质平衡研究”的概念,建议在药物Ⅲ期临床试验前完成该研究,同时也鼓励尽早实施,以发现人体是否存在不成比例代谢产物(代谢产物的暴露接近或大于药物总暴露量的10%,且未在动物种属中发现或人体中暴露水平远大于动物),进而开展安全性评价。EMA在2013年的肿瘤药物人体评价指南(表1)中强烈推荐进行人体物质平衡研究,同时在药物相互作用指南(表1)中对此类试验的相关要求进行了具体而详尽的描述。
| 图表编号 | XD00228914700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.07.22 |
| 作者 | 马晟、易玲、缪丽燕 |
| 绘制单位 | 苏州大学附属第一医院国家药物临床试验机构、苏州大学药物研究与转化交叉研究所、苏州大学附属第一医院国家药物临床试验机构、苏州大学附属第一医院国家药物临床试验机构、苏州大学药物研究与转化交叉研究所 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式