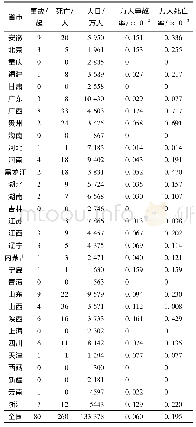
《表8 国内已获批的生物类似药Ⅲ期临床有效性比对研究概况(截至2020年7月)》
以上试验信息来自CDE临床试验登记网站,CDE网站上未区分主要药动学和次要药动学指标;a:ASAS20译为:国际评估工作组相关评分至少改善20%
4个单抗生物类似药Ⅲ期试验设计中(见表8),疗程普遍长于主要疗效终点评价时间,汉利康(利妥昔单抗生物类似药)、安可达和达攸同(贝伐珠单抗生物类似药)的疗程甚至达到1年或者更长。除了伦理委员会的要求,这样设计主要是为了深入全面地进行安全性和免疫原性的比对研究。然而,由于和主要疗效终点评价点不一致,给临床实际操作带来一定困难,最终能进行安全性和免疫原性评价的病例数量有限。同时,由于在药动学研究和有效性研究中只考虑药动学和有效性的相似性来计算样本量,没有考虑到充分的安全性暴露,样本量的估算也存在一定争议。因此在生物类似药临床研究中可做进一步的考虑和探讨:如将安全性和免疫原性的评价时间点和主要疗效终点的评价时间点保持一致或者药品上市之后再评价安全性和免疫原性。如此,一方面可以对Ⅲ期试验中的试验组样本量做出规定,另外一方面也可以为上市后药物警戒提出明确和详细要求。
| 图表编号 | XD00218142100 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.11.15 |
| 作者 | 王兰 |
| 绘制单位 | 中国食品药品检定研究院卫生部生物技术产品检定方法及标准化重点实验室国家药品监督管理局生物制品质量研究与评价重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式