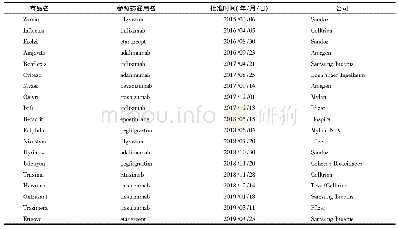
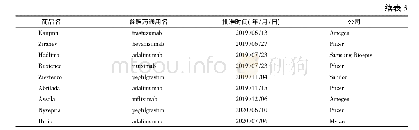
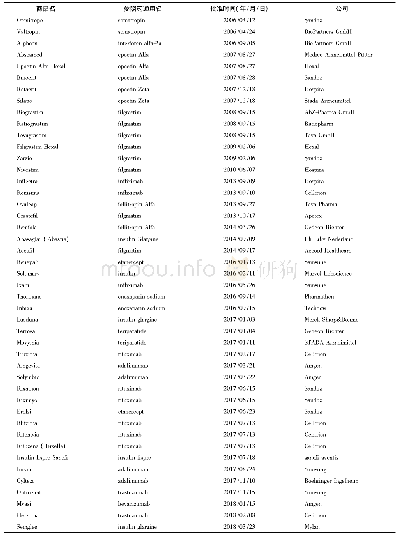
《表5 部分处于Ⅲ期临床研究的国产生物类似药(截至2020年7月)》
以上试验信息来自中国临床试验信息登记和公示平台
生物类似药的名称和定义在国际上并未完全统一(表1),我国将生物类似药定义为在质量、安全性和有效性方面与已获准注册的参照药具有相似性的治疗用生物制品[1]。欧洲是最早发展生物类似药的地区,欧洲药品管理局(EMA)于2004年发布的《生物类似药指南(草案)》,为生物类似药发展奠定了坚实的基础。随后EMA又陆续针对粒细胞集落刺激因子、胰岛素、人生长激素、重组促红细胞生成素、小分子肝素、重组人干扰素α、重组人干扰素β、促卵泡素、单克隆抗体等9个细分领域出台了相应的指导原则[2-3],形成了目前最完善的生物类似药审批和监管体系,为全球生物类似药发展提供了宝贵的经验。自2006年EMA批准了全球第1个生物类似药以来,随着大批重磅生物药专利保护相继到期,生物类似药的发展进入快车道。迄今为止EMA共批准了68个生物类似药,其中单抗类似药30个(见表2)[4]。2009年美国通过《生物制品价格竞争和创新法案》,截至目前,美国FDA共批准了28个生物类似药,其中单抗类药物最多(19个,见表3)[5]。目前我国的生物药物研究还处于初级阶段,研发生物类似药的难度相对新药较低,由仿制药过渡到创新药会更好地促进我国生物医药的发展。2015年2月,我国由国家药品监督管理局药品审评中心(CDE)发布了《生物类似药研发与评价技术指导原则(试行)》,至此我国建立了生物类似药评价管理工作的基本原则。2019年2月首个国产生物类似药———利妥昔单抗注射液(汉利康)获国家药品监督管理局(NMPA)批准上市,填补了我国生物类似药领域的空白,截至2020年7月,我国已上市4种共6个生物类似药(见表4),在研究生物类似药项目的靶点主要集中在血管内皮生长因子(vascular endothelial growth factor,VEGF)、人表皮生长因子受体-2 (human epidermal growth factor receptor2,HER2)、CD20、肿瘤坏死因子α(tumor necrosis factorα,TNF-α),见表5。
| 图表编号 | XD00218141800 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.11.15 |
| 作者 | 王兰 |
| 绘制单位 | 中国食品药品检定研究院卫生部生物技术产品检定方法及标准化重点实验室国家药品监督管理局生物制品质量研究与评价重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式