《表7 FDA的相似性评价分级评估方法》
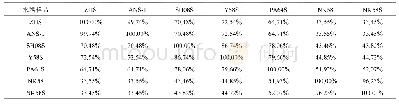
药学比对研究设计依赖于对参照药和候选生物类似药的异质性详细了解,并参考ICH Q6B设置需比较的质量属性,评估每个质量特性与临床效果的相关性,设立判定相似性的评价标准。在生物类似药的质量比对研究中,FDA建议根据质量属性对临床的影响将其分成3个层级,采用不同的方法评价候选药与参照药的相似性(见表7)[11,15]。EMA除了建议以参照药的质量上下限作为相似性区间之外,也倡导使用统计的方法分析生物类似药的质量可比性[16]。例如,美国Amgen公司在美国和欧洲获批的生物类似药ABP501采用FDA推荐的3-Tier法进行了全面的药学相似性评价研究。研究中共使用24批美国获批的参照药,18批欧洲获批的参照药以及10批ABP501候选药。首先,详细列出了拟进行评价的质量属性及其研究方法,主要包括:一级结构、高级结构、颗粒和聚体、产品相关杂质、热稳定性、一般特性、产品相关杂质及生物学活性等。然后,根据质量属性对安全性、有效性、免疫原性的潜在影响进行Tier风险分级及统计方法确定:(1)与作用机理相关的临床风险最高或与作用机理直接相关的质量属性分级为Tier 1,如可溶性TNFα结合活性,凋亡抑制活性;采用等效性检验法进行可比性评价,评价标准为:均值差值的90%置信区间处于等效界值(equivalence margin,EAC)范围内即为等效,等效界值取值为±1.5倍参照药标准差(±1.5SDR)。(2)对于临床风险相对较低的质量属性分级为Tier 2,如电荷变体、糖型、纯度及杂质含量、蛋白质含量、抗体依赖的细胞介导的细胞毒性作用(antibody-dependent cell-mediated cytotoxicity,ADCC)和补体依赖的细胞毒性(complement dependent cytotoxicity,CDC)活性等;采用控制范围法进行评价,评价标准为:90%以上本品批次落在参照药控制范围内(Mean±3SDR)即为相似。(3)对于临床风险最低或不可量化的质量属性分级为Tier 3,如肽图、分子量、差示扫描量热法(differential scanning calorimeter,DSC)、热稳定性等;采用图谱对比法或描述法进行评价。最后,采用经过验证的分析方法进行全面的质量相似性评价研究,收集研究结果进行统计学分析,并结合风险分析结果确定研究结论。再例如,中国食品药品检定研究总院同样采用FDA推荐的3-Tier法对贝伐珠单抗生物类似药和相应参照药进行了全面的药学相似性评价研究,研究中共使用18批NMPA批准的参照药和10批相应候选药,结果显示候选生物类似药与参照药在药学方面高度相似[17]。此外,对于采用多种方法评价同一质量属性的情况,可以将这些方法获得的结果分别归属于不同的层级[11,18]。例如,相对偏差比较小的某些活性方法如基于报告基因法的ADCC检测方法,可以敏感地发现ADCC的微小变化,但基于报告基因法的测试并不能完全体现体内的活性,可选用更能代表体内活性的方法对ADCC进行同期评估,并且将最有代表性的方法赋予最高的层级,选用最严格的统计规则进行相似性评估[19],而通过其他方法测得的数据可以选用低层级对应的更宽松的统计规则进行相似性评估。
| 图表编号 | XD00218140000 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.11.15 |
| 作者 | 王兰 |
| 绘制单位 | 中国食品药品检定研究院卫生部生物技术产品检定方法及标准化重点实验室国家药品监督管理局生物制品质量研究与评价重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式

![表1 相似性评价分级[18,19]](http://bookimg.mtoou.info/tubiao/gif/SCXZ202001007_01700.gif)