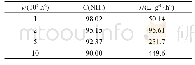
《表2 提高平衡转化率和反应速率的措施》
通过启发式的教学方法,学生清晰地明白为什么现在工业上合成氨的条件是:压强:2×107–5×107 Pa;温度:700 K左右,使用铁触媒作为催化剂;适时将氨液化分离,N2、H2循环使用,适当提高氮氢比(实际应用n(N2):n(H2)=1:2.8),这是因为氮的活化吸附是该反应的速度控制步骤,适当提高氮含量,有利于提高反应速率。对于以上分析,对合成氨反应的前沿方向也有了一个清晰的了解,即低温高效合成氨催化剂的设计和开发,比如构建双活性中心催化剂,使N2和H2的活化及中间产物的吸附发生在不同的活性中心上,从而打破了反应能垒与吸附能之间的限制关系[5]。通过这一典型案例分析,学生清晰地了解到任何一个反应的工业化过程都需要从热力学和动力学两方面去综合考虑,更能够从中感知前人在探索和改造自然的过程中所经历的认识与思考、偶然与必然,从而给学生以思维能力与科学方法层面的启迪。
| 图表编号 | XD00187628800 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2021.01.28 |
| 作者 | 纪敏、王新葵、孙延波、王旭珍、王新平 |
| 绘制单位 | 大连理工大学化工学院化学系、大连理工大学化工学院化学系、大连理工大学化工学院化学系、大连理工大学化工学院化学系、大连理工大学化工学院化学系 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式