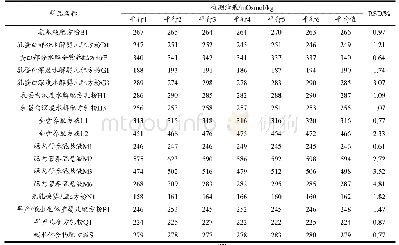
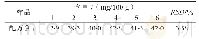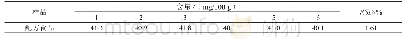《表3 特殊医学用途配方食品主要法规标准对比》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《国内外特殊医学用途配方食品法规标准与安全管理对比分析》
注:本研究重点关注非婴幼儿特殊医学用途配方食品内容
对于特殊医学用途配方食品,部分国家具有相对完善的法规以及针对性的标准,如中国、欧盟、日本等。在国际食品法典标准体系中,CAC制定的《特殊医学用途配方食品标签和声称标准》(CODEX STAN 180—1991)[10],主要为各国制定这类食品标准提供参考(包括定义、使用规定等);我国法规分为《食品安全法》、食品安全国家标准和注册管理配套的文件;欧盟在特殊医学用途配方食品方面起步较早,相关法规经多次修订,相对比较完善,2009/39/EC指令规定在欧盟任一成员国首次上市特殊营养用途食品,其生产商或进口商应当向主管当局提交产品标签样稿以进行通报,(EU)No 609/2013条例[11]规定了特殊医学用途食品等不同类别食品的一般成分和信息要求,(EU)2016/128[12]对具体成分和信息要求进行了规定,也同样规定了上市前需要通报的要求;美国于1988年在《罕见病药物法案》中首次对医用食品进行了定义,并纳入了美国联邦法规第21卷第101.9(j)(8)节[13],美国对于医用食品的管理相对宽松,食品药品监督管理局(FDA)依据《医用食品生产和进口的监管指导原则》[14]对其进行管理,目前没有适用于医用食品的上市前审核要求;加拿大与美国类似,仅在《食品药品条例》等法规中对特殊膳食用途食品的成分要求(包括必须添加的维生素和矿物质)和标签要求进行了一般规定,均是采取上市后监管的模式;日本是亚洲国家中发展特医食品较早的国家,《健康增进法》第二十六条对特殊用途食品,包括病患用食品的标签和营养标签的基本要求进行了规定,“特殊用途食品的表示许可标准”对病患用食品的标签许可等内容进行了规定[15];澳大利亚新西兰主要在《澳新食品标准法典》第2.9.5部分[16]对特殊医学用途配方食品进行了规定,澳大利亚新西兰的特殊医学用途配方食品产品基本来自进口(表3)。
| 图表编号 | XD00179568000 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.05.28 |
| 作者 | 李湖中、孙大发、屈鹏峰、方海琴、刘爱东、李晓瑜、李宁 |
| 绘制单位 | 国家食品安全风险评估中心、国家食品安全风险评估中心、青岛大学公共卫生学院、国家食品安全风险评估中心、国家食品安全风险评估中心、国家食品安全风险评估中心、国家市场监督管理总局、国家食品安全风险评估中心 |
| 更多格式 | 高清、无水印(增值服务) |