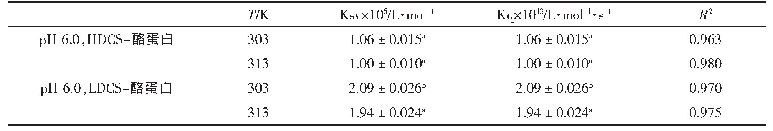《表3 不同条件下过氧化氢和氧气的释放速率常数》
注:a在一定pH下,随着温度升高,k(H2O2)增加量;b在一定pH下,随着温度升高,k(O2)增加量;c在给定温度下,随着pH增加,k(H2O2)和k(O2)的降低量。
由表3可见,在相同条件下,k(H2O2)数值明显大于k(O2),表明过氧化钙转化为过氧化氢和氧气时释放H2O2是主要反应。虽然提高pH会显著降低释放速率常数,但在相同温度下k(H2O2)的下降百分比相对大于k(O2)。这意味着随着pH的增加,k(H2O2)的下降速度要快于k(O2)。这一发现表明其他条件不变时,增加pH,相对于O2的产生,H2O2形成会被更严重地抑制。因此,pH增加会增加O2的产量。此外,在固定pH下,温度升高可以提高H2O2和O2的释放速率,但在较高的pH下,k(O2)对温度更为敏感。pH为6.5时k(O2)增长率仅为38.46%,随着温度的升高,pH为8时k(O2)增长率达到166.67%。因此,与过氧化氢释放速率相比,温度升高会导致氧气释放速率更大幅度地增加。这意味着随着温度的升高,氧气的产生量将上升。
| 图表编号 | XD00147831100 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.08.20 |
| 作者 | 蒲生彦、侯国庆、吕雪、李博文 |
| 绘制单位 | 成都理工大学生态环境学院、国家环境保护水土污染协同控制与联合修复重点实验室、中国环境科学研究院环境基准与风险评估国家重点实验室、成都理工大学生态环境学院、国家环境保护水土污染协同控制与联合修复重点实验室、成都理工大学生态环境学院、国家环境保护水土污染协同控制与联合修复重点实验室、成都理工大学生态环境学院、国家环境保护水土污染协同控制与联合修复重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式