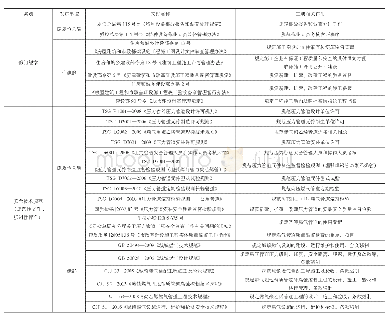
《表1 药品监管相关许可审批部门》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《我国药品与保健食品、特医食品、新资源食品的界定和监管比较》
中国境内上市的药品应获得注册批准,其研制应遵守药物非临床研究质量管理规范(GLP)和药物临床试验质量管理规范(GCP),生产和经营应分别遵守药品生产质量管理规范(GMP)和药品经营质量管理规范(GSP)。自2019年12月1日起,临床试验机构取消资格认定,实施备案管理;生产和经营方面也取消了GMP、GSP认证,不再颁发GMP、GSP证书。此外,化学原料药不再颁发药品注册证书,由化学原料药生产企业在原辅包登记平台上登记,实行一并审评审批[15]。虽然部分认证工作取消,但各质量管理规范仍是监管标准,药品注册、生产和经营都需获得相应的许可资质。表1为药品监管相关许可审批部门。其中在药品注册时,国家药品监督管理局药品审评中心代表国家药品监督管理局作出行政许可决定。
| 图表编号 | XD00132312200 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.02.28 |
| 作者 | 唐辉、汤立达 |
| 绘制单位 | 天津药物研究院、天津药物研究院 |
| 更多格式 | 高清、无水印(增值服务) |