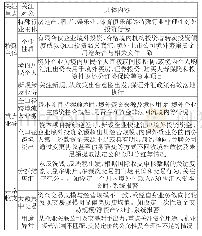
《表4 药品事中事后监管的政府部门联席会议》
药品监管领域的产业新业态、交叉业态和仿药类边缘产品涉及了多领域、多部门、多学科,需要构建和完善药品事中事后监管的部际、省际联席会议协调机制(见表4)。2019年9月,《国务院关于加强和规范事中事后监管的指导意见》提出,要抓紧清理规范和修订完善“边界模糊、执行弹性大的监管规则和标准”,即政府监管的合规性建设问题。确立新业态、交叉业态、网络产品的监管边界,以及药品监管横向和纵向的监管职权,以增加政府监管相关部门之间治理结构的协调性。事中事后监管的“清单制”事项、“双告知”、“双随机”抽查、“信用制”联合惩戒等监管工具,通过平台推送至相关审批、监管部门,由对应部门单位进行认领并监管,实现政府部门之间的协调机制。强化第三方平台、行业协会、企业自检自查等,也是一个药品安全社会共治的实现指标,事中事后监管工作机制也将检验药品社会共治的绩效和能力。
| 图表编号 | XD00219982700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.07.01 |
| 作者 | 王广平、胡骏、李香玉 |
| 绘制单位 | 上海市食品药品安全研究中心、上海市食品药品安全研究中心、上海药品审评核查中心 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式