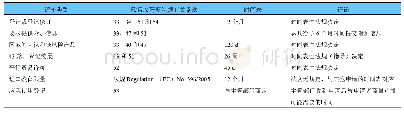
《表5 2016年各种申请类型的审评时限与实际审评时间》
a:此计数中包括待审批的BLA和510(k);b:在没有咨询委员会意见的情况下,于180 d内审查决定,否则可在320 d内进行审查;c:基本等效或基本不等效
FDA对组合式医药产品的审评时间进行了规定,不同产品的申请类型其审评时限不同。审评时限反映了目前对在规定时间内审查的上市前审评部分的时间预期。时限目标只适用于特定类型的所有应用审评的一部分,而不要求每一份申请都要根据适用的时间框架进行审核[6]。2016年OCP提交的年度报告中对各种申请类型的审评时限与实际审评时间见表5。
| 图表编号 | XD0012190000 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.11.30 |
| 作者 | 李新英、董江萍 |
| 绘制单位 | 沈阳药科大学工商管理学院、国家药品监督管理局食品药品查验中心 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式