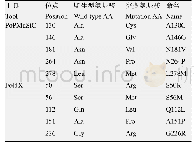
《表1 近年来增强酶的热稳定性的例子》
目前,可以从两个方面来增加蛋白质的热稳定性。一是通过增加有利的相互作用或减少不利的相互作用,稳定折叠状态;二是通过降低展开链的熵,破坏未折叠状态下蛋白质的稳定性[12]。在大多数情况下,引入更多二硫键、氢键、疏水相互作用等分子间相互作用,会使折叠起来的空间结构更加稳定[13-15],同时(β/α)8-barrel折叠、表面电荷、短螺旋、盐桥也会使酶在高温下的构象变得更加稳定[16-18]。由此出发,对结构进行分析比对从而进行理性或者半理性的设计是提高工业酶热稳定性的一种有效策略(表1)。
| 图表编号 | XD00105496800 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.10.25 |
| 作者 | 王文豪、闻鹏飞、许孔亮、郑仁朝、郑裕国 |
| 绘制单位 | 浙江工业大学生物工程学院生物有机合成技术研究浙江省重点实验室、浙江工业大学生物工程学院生物转化与生物净化教育部工程研究中心、浙江工业大学生物工程学院生物有机合成技术研究浙江省重点实验室、浙江工业大学生物工程学院生物转化与生物净化教育部工程研究中心、浙江工业大学生物工程学院生物有机合成技术研究浙江省重点实验室、浙江工业大学生物工程学院生物转化与生物净化教育部工程研究中心、浙江工业大学生物工程学院生物有机合成技术研究浙江省重点实验室、浙江工业大学生物工程学院生物转化与生物净化教育部工程研究中心、浙江工业大学生 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
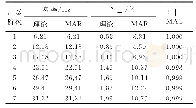

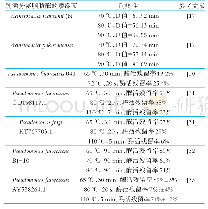

![表3 近年来部分纯港片凭借IP在内地票房成绩稳定[2]](http://bookimg.mtoou.info/tubiao/gif/DYLX202024003_01200.gif)