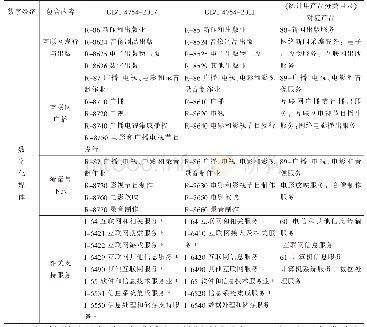
《表6 公告机构医疗器械产品类别框架与分类规则对应情况统计表》
注:统计所用的分类规则/文件与原框架、新框架版本相对应。
经对比分析,为了体现和保证法规系统的一致性和完整性,不管是原框架还是新框架,相关条目的设置和表述与分类规则等管理类别文件[3-8]存在较强的对应性,例如,“有源植入器械(MDA0101~MDA0104)”4个条目均对应规则“8-植入器械和长期使用的手术侵入器械”;“成像、监测和/或诊断用有源非植入器械(MDA0201~MDA0204)”4个条目则均主要对应“规则10-预期用于诊断的有源器械”。由于分类规则与公告机构授权范围划分各自的具体适用环境和目地的差异,两者也并非完全对应,例如,“MDA 0311牙科有源非植入器械”所涉产品品类繁杂,则该条目不能直接与某个条目的分类规则相对应。横向代码中“特定特性”相关条目,主要在于体现产品特性,与分类规则有较强关联性,其他部分横向代码因为表述角度与分类规则差别大,基本上没有对应关系。对应情况统计如表6所示。序号1~3体现的是设计和预期用途方面的特征,与基于预期用途进行风险分类的分类规则比较贴合,特别是新框架和新分类规则关联性更强,因为授权范围代码正式纳入法规框架,因此,两者的一致性显得更加必要,这有利于实际操作,利于对涉及不同风险水平产品的公告机构的有效监管,另一方面也便于公告机构采用分类规则。
| 图表编号 | XD0098591700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.09.20 |
| 作者 | 王越、周良彬、张春青、余新华 |
| 绘制单位 | 中国食品药品检定研究院、广东省医疗器械质量监督检验所、中国食品药品检定研究院、中国食品药品检定研究院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式