《表1 公告机构医疗器械产品类别原框架》
2 0 0 9年3月,欧盟发布的指南B O G-B P G2009-3《指定机构以确定进行医疗器械评估的公告机构的通知范围的指南》(Guideline for Designating Authorities to Define the Notification Scope of a Notified Body Conducting Medical Devices Assessments)[2],在该指导原则中,将医疗器械分为无源医疗器械、有源(非植入)医疗器械、有源植入医疗器械、体外诊断医疗器械、医疗器械和有源植入医疗器械特殊产品、体外诊断医疗器械特殊产品6个初级框架,每个初级框架下分为两个层级,如表1所示。据统计,原框架各个初级框架下条目数量为:有源医疗器械22项(有源植入3项),无源医疗器械19项,体外诊断医疗器械21项,特殊医疗器械(含有源植入器械)9项,特殊体外诊断医疗器械5项。表1给出了公告机构医疗器械产品类别原框架基本情况。
| 图表编号 | XD0098591300 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.09.20 |
| 作者 | 王越、周良彬、张春青、余新华 |
| 绘制单位 | 中国食品药品检定研究院、广东省医疗器械质量监督检验所、中国食品药品检定研究院、中国食品药品检定研究院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式



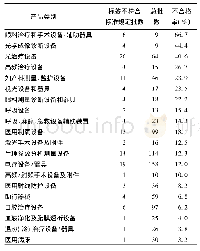

![表2 不同类别医疗器械产品召回原因情况[例(%)]](http://bookimg.mtoou.info/tubiao/gif/YYCY202002012_01000.gif)