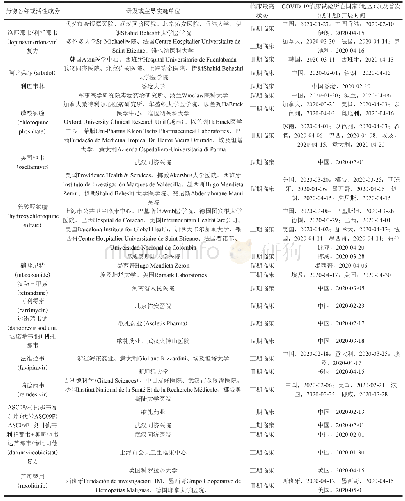
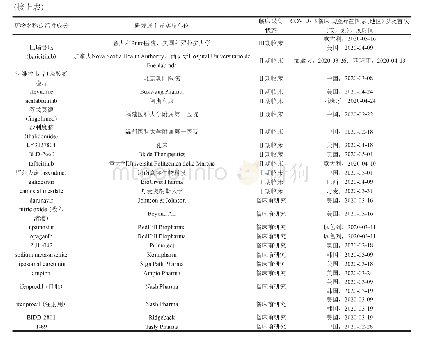
《表2 口服小分子药物治疗脊髓性肌萎缩症的相关临床试验》
SMA,spinal muscular atrophy,脊髓性肌萎缩症;FIREFISH,A Two Part Seamless,Open-Label,Multicenter Study to Investigate the Safety,Tolerability,Pharmacokinetics,Pharmacodynamics and Efficacy of RO7034067 in Infants with Type 1 Spinal Muscular Atrophy;S
系指经高通量筛查(HTS)技术筛选出的促进SMN2基因表达全长SMN蛋白的候选小分子化合物。由于此类化合物口服后可透过血-脑屏障,避免了反复腰椎穿刺鞘内注射的不便,成为目前研究的热点[21-23]。目前有两种口服小分子药物进入早期临床试验阶段,即Branaplam(LMI070)和Risdiplam(RG7916)。其中,Branaplam为瑞士Novartis公司研发的调节SMN2基因剪接的口服小分子药物,早期动物实验证实其可延长脊髓性肌萎缩症模型小鼠预期寿命,并可提高功能性SMN蛋白表达水平[24]。2015年4月,Branaplam进入Ⅰ和Ⅱ期临床试验(试验编号:NCT02268552),募集SMA1型患者,拟通过评价治疗13周后的药物安全性、耐受性、药代动力学和药效学,而制定最佳剂量方案;然而同期进行的动物实验显示,该药对周围神经、脊髓、睾丸、肾血管具有毒性,故于2016年暂停试验(www.curesma.org/news/update-novartis-lmi070.html);经重新调整剂量后于2017年9月再次启动,目前试验仍在进行中。Risdiplam是瑞士Roche公司和美国PTC Therapeutics公司合作研发的调节SMN2基因剪接的口服小分子药物[25-26],其Ⅰ期临床试验已完成[12],并进入Ⅱ期临床试验,包括针对无症状性SMA1型的Rainbowfish研究、针对SMA1型的FIREFISH研究、针对SMA2型或SMA3型的SUNFISH研究以及针对成人和儿童脊髓性肌萎缩症的Jewelfish研究(表2)。2018年10月召开的第23届世界肌肉协会国际年会公布了上述临床试验的中期分析结果,FIREFISH研究纳入中期分析的14例SMA1型患儿,经Risdiplam治疗后6例达到独坐的运动发育里程碑,治疗8个月后3例实现无辅助稳定独坐;8例费城儿童医院婴儿神经肌肉病测验(CHOP-INTEND)评分>40分;该项研究纳入的21例患儿中有19例生存。而SUNFISH研究入组患儿经Risdiplam治疗后12个月,全长SMN蛋白表达水平较基线提高2倍以上,运动功能评价量表(MFM)评分较基线增加3.10分。
| 图表编号 | XD0096227200 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.06.25 |
| 作者 | 利婧、张成 |
| 绘制单位 | 中山大学附属第一医院神经科、中山大学附属第一医院神经科 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
![表3 治疗早老症的临床试验[76]](http://bookimg.mtoou.info/tubiao/gif/ZYXW202001034_03300.gif)
![表3 小分子靶向药物临床使用情况[n(%)]](http://bookimg.mtoou.info/tubiao/gif/LCYW202005009_02700.gif)