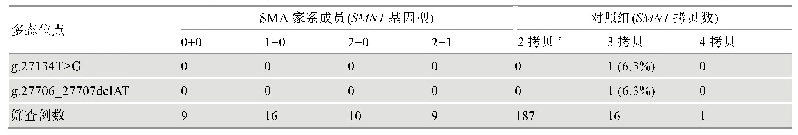
《表1 反义寡核苷酸治疗脊髓性肌萎缩症的相关临床试验》
SMA,spinal muscular atrophy,脊髓性肌萎缩症;CS3A,An Open-Label,Dose Escalation Study to Assess the Safety,Tolerability and Dose-Range Finding of Multiple Doses of ISIS 396443 Delivered Intrathecally to Patients with Spinal Muscular Atrophy;EMBRACE,A P
反义寡核苷酸是人工合成的短链核酸序列,长度为8~50 bp,可以选择性地与信使RNA(mRNA)结合,从而影响RNA翻译启动或改变外显子剪接。由于脊髓性肌萎缩症患者至少存在1个SMN2基因拷贝,因此,通过特异性反义寡核苷酸改变SMN2 pre-mRNA的剪接,使其能够翻译表达全长SMN蛋白,理论上适用于所有脊髓性肌萎缩症患者[16]。Nusinersen(曾用名IONIS-SMNRX,商品名Spinraza)是首个经美国食品与药品管理局(FDA)和欧洲药物管理局(EMA)批准用于治疗脊髓性肌萎缩症的反义寡核苷酸药物,并于2019年2月获得国家食品药品监督管理总局(CFDA)批准正式在国内上市。Nusinersen是一种经修饰的反义寡核苷酸,可特异性地识别SMN2基因内含子7剪接沉默子N1序列(ISS-N1),通过阻断负性调控位点通路以调节SMN2 pre-mRNA转录本的剪接,达到增加SMN2基因外显子7的翻译剪接目的。体外实验和动物实验均已证实,Nusinersen可上调全长SMN蛋白的表达水平[16-18]。由于反义寡核苷酸不易透过血-脑屏障,因此仅能鞘内给药;根据早期临床试验结果,鞘内注射不仅安全且患者耐受良好[19]。Ⅱ期临床试验CS3A研究(表1)以20例3周至7个月脊髓性肌萎缩症患儿作为观察对象,于入组后1、15和85天鞘内注射Nusinersen 6 mg(4例)或12 mg(16例),此后每4个月鞘内注射12 mg,至试验结束时(入组后253天)以Hammersmith婴儿神经系统检查(HINE)评价运动发育里程碑(包括头部控制、坐位、仰卧位踢腿、翻身、爬行、站立、行走),结果显示,12 mg组患儿HINE评分增加,运动功能改善;中期分析结果显示,存在2个SMN2基因拷贝的患儿(17例)Kaplan-Meier生存曲线生存率高于儿童神经肌肉病临床研究(PNCR)中自然病程患儿(P=0.001);3例死亡患儿尸检发现,脊髓运动神经元中有15%~26%的SMN2 mRNA转录本包含外显子7片段,其全长转录本表达水平较未经治疗的患儿增加2.60倍,表明鞘内注射Nusinersen后可自脑脊液分布至整个中枢神经系统,并可进入运动神经元、血管内皮细胞和神经胶质细胞,不仅安全且可耐受[18]。CS3A研究后进行的一项多中心随机对照双盲Ⅲ期临床试验ENDEAR研究(表1)纳入121例≤7个月脊髓性肌萎缩症患儿,按照2∶1的比例随机分为Nusinersen组(80例)和安慰剂组(41例),对78例疗程达6个月的患儿进行中期分析,结果发现Nusinersen组(51例)有21例(41.18%)HINE评分增加,而安慰剂组(27例)无明显变化;最终110例完成试验,Nusinersen组(73例)37例(50.68%)HINE评分增加,安慰剂组(37例)无明显变化;Nusinersen组患儿达到运动发育里程碑的项目包括头部控制(22%)、翻身(10%)、独坐(8%)和站立(1%),安慰剂组则均未达到;Nusinersen组患儿病死或接受永久性辅助通气治疗的比例低于安慰剂组(39%对68%;HR=0.530,95%CI:0.320~0.890,P=0.005)[9]。基于中期分析的阳性结果,ENDEAR研究提前终止。Nusinersen于2016年12月获得美国食品与药品管理局批准用于治疗脊髓性肌萎缩症(https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm534611.htm)。关于年龄较大脊髓性肌萎缩症患儿获益的证据来自一项获得阳性结果临床试验的中期分析,即CHERISH研究(表1),该项研究共纳入126例2~12岁脊髓性肌萎缩症患儿,按照2∶1比例随机分为Nusinersen组(84例)和安慰剂组(42例),中期分析证实患儿获益后该项研究也提前终止;至试验终止时,治疗15个月的Nusinersen组患儿Hammersmith运动功能评价量表扩展版(HFMSE)评分平均增加3.90分,安慰剂组减少1分(95%CI:3.100~6.700),差值≥3分即具有临床意义[10]。ENDEAR和CHERISH试验提前终止后,该两项研究的受试患儿随之进入后续的开放性Ⅲ期延长试验SHINE研究(表1),中期分析显示,在ENDEAR和SHINE试验中均连续用药的患儿其HINE-2总评分较基线增加5.80分(95%CI:4.580~7.040),高于ENDEAR试验中使用安慰剂而在SHINE试验中用药的患儿(1.10分,95%CI:0.200~1.900);两项试验中均连续用药的65例患儿中28%达到头部完全控制,15%可独坐和站立[11]。不过,Nusinersen长期重复使用的安全性和耐受性尚待进一步研究。美国食品与药品管理局业已批准鞘内注射Nusinersen用于治疗脊髓性肌萎缩症,推荐剂量为12 mg(规格:12 mg/5 ml),建议开始时予4次负荷剂量,前3次每次间隔14天、第4次与第3次间隔30天,此后每4个月予一次维持剂量,终身用药。鞘内注射Nusinersen的常见不良反应包括呼吸道感染和便秘,亦可并发血小板减少症、凝血功能障碍,同时存在肾毒性风险[20]。因此建议,基线和每次给药前测定血小板计数、凝血酶原时间(PT)、活化部分凝血活酶时间(APTT),以及随机测定尿蛋白定量等。
| 图表编号 | XD0096227100 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.06.25 |
| 作者 | 利婧、张成 |
| 绘制单位 | 中山大学附属第一医院神经科、中山大学附属第一医院神经科 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式



![表3 治疗早老症的临床试验[76]](http://bookimg.mtoou.info/tubiao/gif/ZYXW202001034_03300.gif)