《表2 中国香港特别行政区与中国大陆技术性注册申报资料的对比》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
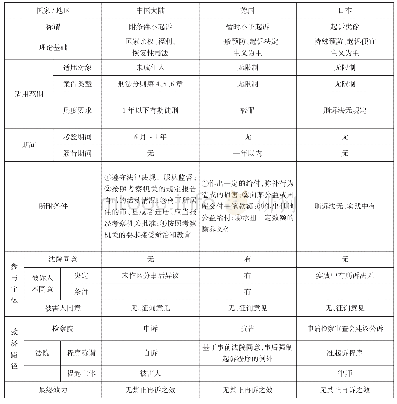
《中国香港与中国内地中药注册分类及技术性申报资料要求的对比》
(1) -只适用于皮肤或黏膜使用的中成药。(2)于中国香港中成药注册法例生效后(即于2003年12月9日及以后),才在中国香港销售或制造的中成药,有关申请人必须于申请该中成药注册时即时提交完整的报告。(3)于过渡性注册申请截止日后(即于2004年6月30日后),才在中国香港销
根据中国香港《【中成药注册】申请手册》可知,中国香港中成药固有药类别可选择的注册组别为I、II、III组,其中第I组别所需提交的资料最少。中国香港中成药非固有药注册组别的要求与固有药注册组别一致,中国香港中成药新药类别需按注册第III组别进行申报。结合《药品注册管理办法》(局令第28号)[1]及《国家药品监督管理局关于发布古代经典名方中药复方制剂简化注册审批管理规定的公告》(2018年第27号)[2],可得表2。
| 图表编号 | XD0081228700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.08.08 |
| 作者 | 孙昱 |
| 绘制单位 | 国家药品监督管理局药品审评中心 |
| 更多格式 | 高清、无水印(增值服务) |