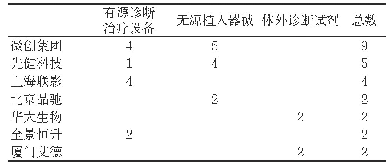
《表1 2014~2017年创新医疗器械特别审批情况 (项)》
注:数据来源原国家食品药品监督管理总局医疗器械注册工作报告。
2014年以来,我国积极营造鼓励创新的政策氛围,推进医疗器械创新驱动发展轨道[2]。2014年2月,食药监制定并颁布了《创新医疗器械特别审批程序(试行)》,该程序在保障医疗器械安全、有效的前提下,鼓励医疗器械的研究与创新,促进医疗器械新技术的推广和应用[3],以此拉开了中国创新医疗器械蓬勃发展的序幕。同年7月,原国家食品药品监督管理总局令第4号——《医疗器械注册管理办法》颁布,自2014年10月1日起施行。该管理办法在总则中明确指出“国家鼓励医疗器械的研究与创新,对创新医疗器械实行特别审批,促进医疗器械新技术的推广与应用,推动医疗器械产业的发展”[4],正式把创新医疗器械纳入医疗器械注册管理办法中。办法还规定,创新医疗器械在注册时,样品可以委外生产,是新法规针对创新医疗器械出台的绿色通道。随后,各配套政策文件陆续出台[5-7],全面鼓励国产医疗器械创新,表1总结了创新医疗器械特别审批政策出台以来我国创新医疗器械的审批情况,呈逐年增长趋势。
| 图表编号 | XD0060644600 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.02.10 |
| 作者 | 杨辉、胡凯 |
| 绘制单位 | 浙江省医疗器械审评中心、浙江省医疗器械审评中心 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式