《表2 比对试验结果:可比性验证与线性评价方法在生化分析仪确认中的应用初探》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《可比性验证与线性评价方法在生化分析仪确认中的应用初探》
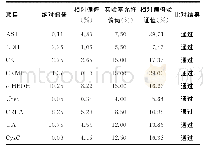
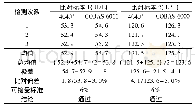
同一医疗机构内,对同一定量检验项目的多个检测系统应进行可比性验证,特别是血站系统,血液检验结果以检验科湿化学法检测为准,采血前初筛的检测结果应与检验科检测结果具有可比性,以减少血液报废。因此,我们在新购4040+生化分析仪的确认过程中,引进了“可比性验证”。从本次确认结果看,我们发现可比性验证关键内容包括:1) 估计检测结果的不精密度。由表1可知,低浓度质控品2种设备总平均值为53.5 U/L、总不精密度CV合并为1.8%;高浓度质控品2种设备总平均值为123.4 U/L、总不精密度CV合并为2.8%;2) 确定比对标本浓度。以每个质控品浓度水平的总均值m总×(1±20%)作为比对标本浓度的选择范围,选取46.6 U/L(比对标本1)和120 U/L(比对标本2)的质控品作为本次可比性验证的比对试验标本;3) 建立比对试验的可接受标准。根据WS/T 407-2012文件6.7.2,可以依据生物学变异确定分析质量要求,如果查阅资料未发现相关临床研究结果提供建议,也没有相关临床医生建议,对于精密度检测结果符合要求的检测系统,同一检测项目可比性结果的允许差异可以设定为个体内生物学变异(CV)的1/3。ALT的个体内生物学变异(CV)一般约18%,故将CV的1/3即6%作为可接受标准;4) 确定每份标本的重复检测次数。根据WS/T 407-2012文件要求,总不精密度CV合并位于1%—3%之间,而之前确定的可接受标准为6%,可以选择重复2次或3次检测;5) 比对试验。由表2可知,2个浓度标本的比对偏差均小于6%的分析质量要求,4040+生化分析仪和CO-BAS-6000生化分析仪检测ALT的结果可比性是可接受的。
| 图表编号 | XD003975600 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2018.09.25 |
| 作者 | 王拥军、潘凌凌、韩浙东 |
| 绘制单位 | 浙江省血液中心、浙江省血液中心、浙江省血液中心 |
| 更多格式 | 高清、无水印(增值服务) |