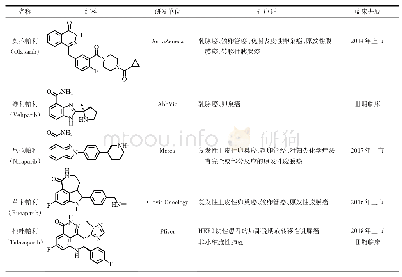
《表1 蛋白磷酸酶变构抑制剂》
PTP1B:protein-tyrosine phosphatase 1B(蛋白酪氨酸磷酸酶1B);SHP2:Src homology 2 domain-containing protein tyrosine phosphatase(含Src同源2结构域蛋白酪氨酸磷酸酶);LYP:lymphoid tyrosine phosphatase(淋巴酪氨酸磷酸酶);CD45:leukocyte common antigen(白细胞
由于蛋白激酶的激活功能往往与肿瘤等疾病直接相关,因此蛋白激酶很早就被作为药物靶点来进行研究,其抑制剂也已进入临床应用,然而,蛋白磷酸酶抑制剂的研究相对较少。作为蛋白激酶的主要拮抗蛋白,蛋白磷酸酶一开始被简单地认为是肿瘤抑制因子,但后来随着研究的深入,人们发现一些蛋白磷酸酶本身可能就是致癌因子,并且一些导致蛋白磷酸酶持续激活的基因异常已被证实在肿瘤等疾病中广泛存在,是重要的原癌基因。随着对蛋白磷酸酶去磷酸化作用的研究继续深入,蛋白磷酸酶抑制剂的潜在临床治疗价值得到越来越多的实验验证;同时,对蛋白磷酸酶活性有调节作用的小分子也为致病机制研究提供了重要的工具。早期有一些天然产物被发现具有蛋白磷酸酶抑制能力,但它们均主要在两个方面存在一些问题而最终无法进入临床应用:一是特异性问题,这些抑制剂多作用于磷酸酶的催化域,而同家族蛋白磷酸酶催化域高度保守,抑制剂难以区分不同亚型的磷酸酶,从而带来潜在的副作用,并给药理机制研究造成困难;二是蛋白磷酸酶的催化域往往带有正电荷,更倾向于结合带负电的分子,而带负电荷的小分子抑制剂本身在代谢和生物利用度方面处于弱势。最早,人们设计蛋白磷酸酶底物类似物来竞争蛋白磷酸酶的作用,但绝大多数都因成药性差而失败。直到最近,一些分子通过作用于蛋白磷酸酶催化域以外的潜在口袋来调节蛋白磷酸酶的活性(见表1),巧妙地回避了蛋白磷酸酶催化域抑制剂特异性差和成药性差的问题,这些新的蛋白磷酸酶变构抑制剂的问世为蛋白磷酸酶的研究带来新的活力,也让蛋白磷酸酶作为药物靶点重获希望。本文就目前热门的蛋白磷酸酶变构抑制剂的研究进展作一综述,希望为更多新的蛋白磷酸酶变构抑制剂研究带来启发。
| 图表编号 | XD00228035400 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.08.25 |
| 作者 | 曹恒义、朱继东 |
| 绘制单位 | 中国科学院上海有机化学研究所生物与化学交叉研究中心、中国科学院上海有机化学研究所生物与化学交叉研究中心 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
![表1-4神经氨酸酶抑制剂用药方案[12,14-15]](http://bookimg.mtoou.info/tubiao/gif/YAXU202010002_00900.gif)