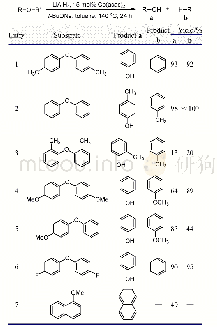
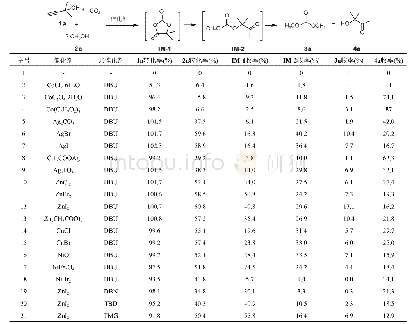
《表1 过渡金属催化剂及共催化剂催化炔丙醇、甲醇和CO2三组分反应性能考察a)》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《多组分串联策略固定CO_2制碳酸二甲酯和α-羟基酮》
a)反应条件:1a(420.5 mg,5 mmol),2a(320.4 mg,10 mmol),催化剂(1 mmol),共催化剂(2.5 mmol),DMF(1 mL),CO2(2 MPa),100°C,10 h.以联苯作为内标物,气相色谱分析定量
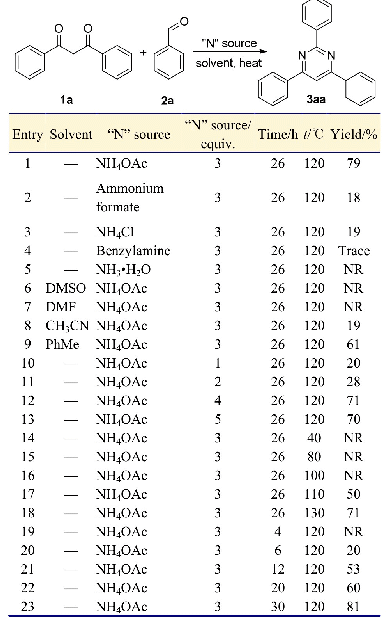
首先,以2-甲基-3-丁炔-2-醇(1a)、甲醇(2a)和CO2三组分反应作为模板反应进行后续研究.以DBU作为共催化剂(表S2),在2 MPa、100°C和1 mL DMF条件下合成DMC(3a)和3-羟基-3-甲基-2-丁酮(4a).随后选择考察了一系列钴盐、银盐和锌盐的催化活性(表1).当不使用任何催化剂时,反应不发生(表1,序号1).另外CoCl2·6H2O没有表现出催化活性(表1,序号2).以CoC2O4·2H2O、Co(C5H7O2)3、Ag2CO3、CH3COOAg或NiBr2为催化剂时,得到较低收率的目标产物3a,但同时得到了较高收率的4a(表1,序号3~5,8,18).从实验结果来看,1a转化率高于90%,但2a转化率较低,说明α-亚甲基环状碳酸酯(IM-1)合成是快速反应步骤,甲醇醇解反应速度相对较慢.另外,α-羟基酮收率远高于DMC,证明在强碱性条件下α-羟基酮也会来源于α-亚甲基环状碳酸酯水解[24]或其他路径,即未按照既定路线进行.之后又分别考察了AgBr、AgI、Ag3PO4、ZnCl2、ZnBr2、ZnI2和Zn(CH3COO)2的催化活性(表1,序号6,7和9~13),产物3a收率提高,而4a收率有较大幅度降低其中,碘化锌体系所对应的两种产物收率差距较小,催化既定路线选择性较好,产物3a和4a的收率分别为13.1%和16.2%.以CuCl、CuBr、NiO或NiFe2O4为催化剂时,产物收率有所提高,但中间产物收率明显高于产物,表明该催化条件下反应更多停留在中间产物阶段(表1,序号14~17),后续反应较慢.基于以上结果分析锌盐更有利于该三组分反应的进行,ZnI2为催化剂时产物收率最高.随后,我们对不同碱性共催化剂如DBN、TBD和TMG进行了考察(表1,序号19~21),发现ZnI2/DBU体系下,综合产物收率和选择性表现最好,可见共催化剂碱性对反应有较大促进作用.
| 图表编号 | XD00223467200 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.11.10 |
| 作者 | 张乾霞、刘平、张侃、韩丽华、宋清文 |
| 绘制单位 | 中国科学院山西煤炭化学研究所煤转化国家重点实验室、中国科学院山西煤炭化学研究所煤转化国家重点实验室、中国科学院山西煤炭化学研究所煤转化国家重点实验室、中国科学院山西煤炭化学研究所煤转化国家重点实验室、中国科学院山西煤炭化学研究所煤转化国家重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |