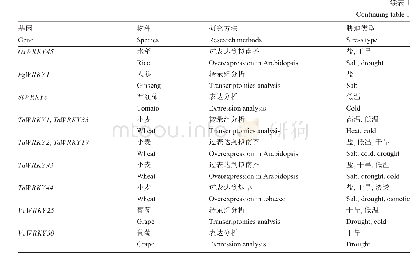
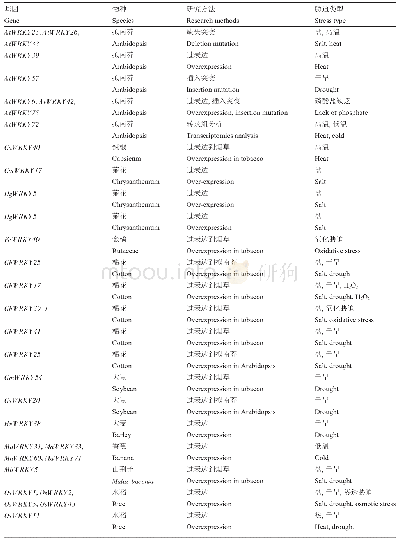
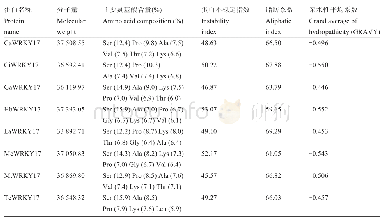
《表3 非生物逆境胁迫相关WRKY17蛋白二级结构预测》
蛋白质的二级结构主要是指蛋白质的多肽链中有规则重复的构象,可利用在线程序SOPMA (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa sopma.html)对其进行预测与分析,主要为α-螺旋、β-折叠、β-转角、无规(则)卷曲所占比例的预测(表3),这四种蛋白质的二级结构通常被主要研究(唐媛等,2013),通过预测和分析将有助于认识蛋白的空间结构。结果显示,与非生物逆境胁迫相关WRKY17蛋白的主要二级结构元件中,无规卷曲所占比例最高(66.57%~71.06%),此外,α-螺旋、β-折叠和β-转角的所占比例依次减少,分别为15.63%~20.30%、7.40%~11.21%和3.54%~5.01%。相较无规卷曲来说,对于维持蛋白质分子空间结构的相对稳定起着重要的作用,主要有α-螺旋和β-折叠,无规卷曲主要有着连接其它几种二级结构元件的作用。因此说明了,Ca WRKY17、Ci WRKY17、Ga WRKY17、Hb WRKY17、La WRKY17、Me WRKY17、Mt WRKY17和Tc WRKY178个转录因子均为不稳定蛋白。由8个与非生物逆境胁迫相关WRKY17转录因子二级结构预测结果可见(图6),它们在二级结构上具有较高的相似性。可见Ci WRKY17和Tc WRKY17的二级结构出现的氨基酸残基的位置比较相近,与Ca WRKY17的氨基酸残基的位置也比较相近。
| 图表编号 | XD00186092500 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.08.25 |
| 作者 | 白明珠、万永青、李国婧、王瑞刚 |
| 绘制单位 | 内蒙古农业大学植物逆境生理与分子生物学自治区重点实验室、内蒙古农业大学植物逆境生理与分子生物学自治区重点实验室、内蒙古农业大学植物逆境生理与分子生物学自治区重点实验室、内蒙古农业大学植物逆境生理与分子生物学自治区重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式