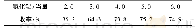《表5 不同氯化剂的直接释氯反应》
为了解氯化剂的分解机理,在干空气条件下通过热重对氯化剂加热过程的质量损失和吸放热情况进行分析.如图7a所示,Ca Cl2在100~130°C下有2个较小的吸热峰,在778°C有1个较大的吸热峰.根据式(14)、(15)、(16)(表5)的DG计算结果(图8a),固体Ca Cl2在低温条件下(100~130°C)很难与H2O/O2反应,样品出现少量的失重可能是因为Ca Cl2中微量的自由水蒸发吸热与Ca Cl2水化物的分解吸热.当温度上升到778°C时,到Ca Cl2的熔点[43],Ca Cl2吸收外界热量转变为熔融状态,因此出现较大的吸热峰,这时候部分Ca Cl2转变为气态导致了质量损失.根据式(17)、(18)、(19)(表5)的DG计算结果,气态Ca Cl2能与H2O/O2反应生成HCl/Cl2,反应降低了气体中Ca Cl2的浓度,进一步促进Ca Cl2蒸发[43],从而增加了质量损失.在805°C时Na Cl的热重曲线上有明显的吸热峰(图7b),并且出现失重现象,此时Na Cl达到熔点[42],Na Cl转变成熔融状态,根据DG计算结果(图8b),Na Cl无论是固态还是气态,都很难与H2O/O2反应生成HCl/Cl2,Na Cl的失重仅仅是由于Na Cl蒸发[38,42].Al Cl3·6H2O的分解温度明显低于Ca Cl2和Na Cl,Al Cl3·6H2O在低温135°C时有明显的吸热峰(图7c),并且由于氧化水解反应[44]在短时间内造成了80%的质量损失,这与DG计算结果一致(图8c),固体Al Cl3与H2O/O2反应的DG均小于零,说明固相Al Cl3可以与H2O/O2反应,在1200°C内范围内生成HCl/Cl2.由上可知,Al Cl3·6H2O的氯释放能力最好,Ca Cl2在达到熔点后才释放氯,Na Cl会挥发进入大气中.
| 图表编号 | XD00178977600 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.05.20 |
| 作者 | 洪雁翔、宁寻安、路星雯、李杨、赖晓君、曾峻、陈长鸿 |
| 绘制单位 | 广东工业大学环境科学与工程学院、广东工业大学环境健康与污染控制研究院广东省环境催化与健康风险控制重点实验室广州市环境催化与污染控制重点实验室、广东工业大学环境科学与工程学院、广东工业大学环境健康与污染控制研究院广东省环境催化与健康风险控制重点实验室广州市环境催化与污染控制重点实验室、广东工业大学环境科学与工程学院、广东工业大学环境健康与污染控制研究院广东省环境催化与健康风险控制重点实验室广州市环境催化与污染控制重点实验室、广东工业大学环境科学与工程学院、广东工业大学环境科学与工程学院、广东工业大学环境健康 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式