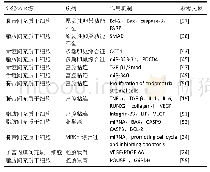
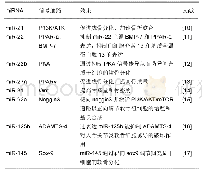
《表1 间充质干细胞源性外泌体携带的mi RNA在骨科的作用》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《间充质干细胞源性外泌体在骨科疾病治疗中的作用与应用前景》
外泌体是细胞外囊泡的一种,直径介于30-150 nm之间,形成于内涵体小室,其包含有大量的蛋白分子、DNA、RNA、m RNA及micro RNA等,能够通过细胞间的传递发挥重要作用。外泌体于1983年首先由HARDING等在大鼠的网织红细胞中发现,1987年JOHNSTONE等将这种小囊泡正式定义为“exosomes”,即外泌体。起初外泌体被认为是一种“细胞垃圾”,直到2007年外泌体介导m RNA和mi RNA转移才被确定为“细胞间遗传交换的新机制”,并引起人们对外泌体的生物学功能进行了更深入的研究。间充质干细胞广泛存在于人体组织中,同时也是产生外泌体能力最强的细胞。间充质干细胞源性外泌体主要通过收集间充质干细胞上清液来获取,主要提取方法有超速离心法、凝胶色谱法、超滤法、免疫磁珠法和试剂盒提取法。使用超速离心法提取的外泌体纯度较高,是目前外泌体研究的主流方法。间充质干细胞源性外泌体可以通过电子显微镜、纳米粒子跟踪分析等方法直接进行观察。另外,可以利用外泌体的一些表面标志物如CD81、CD9、TSG101、ALIX等,通过微流式细胞分析仪、免疫印迹分析、酶联免疫吸附实验进行检测。脂质和蛋白质是构成外泌体膜的重要组成成分,间充质干细胞源性外泌体不仅表达外泌体特异性表面标志物CD9、CD63、CD81、CD92,还表达间充质干细胞特异性表型CD29、CD44、CD73和CD90等[7],同时携带有HSP8、HSP60、HSP70、HSP9、信号转导蛋白(G蛋白)、多泡体产生相关蛋白(Alix、TSG101)等。此外,外泌体可以携带与其来源细胞相类似的一些细胞因子、脂质、各种m RNA、mi RNA、lnc RNAs等生物活性物质,在细胞间信息传递过程中发挥重要作用。目前,对间充质干细胞源性外泌体已经鉴定出850种独特的基因产物以及大于150种micro RNA[8]。间充质干细胞源性外泌体具有多种与间充质干细胞相似的生物学功能,例如促进细胞迁移、增殖、分化和基质合成等[9]。首先,间充质干细胞源性外泌体表面信号蛋白分子或生物活性脂质配体与靶细胞表面受体相结合,产生信号复合体并激活细胞内信号通路;其次,当组织微环境因疾病或损伤而改变时,通过提供催化活性酶以促进组织稳态,间充质干细胞源性外泌体可以快速恢复正常组织功能;再次,作为间充质干细胞分泌的通信载体,mi RNAs的传递可干预靶细胞内目标m RNAs的转录及蛋白质的生成,参与组织修复再生,而mi RNA和lnc RNA可以激活基因表达的转录调节。除以上的作用机制外,与单独应用间充质干细胞相比,间充质干细胞源性外泌体具有诸多的应用优势,如性质稳定、易于保存、低免疫原性、无细胞活性等诸多优势,为多种疾病的治疗提供了新的手段。间充质干细胞源性外泌体携带的mi RNA在骨科的作用,见表1[10-17]。
| 图表编号 | XD00174788800 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.09.08 |
| 作者 | 李嘉、王智慧、吴迪、赵杨 |
| 绘制单位 | 承德医学院附属医院关节外科、承德医学院附属医院关节外科、承德医学院附属医院关节外科、承德医学院附属医院病理科 |
| 更多格式 | 高清、无水印(增值服务) |