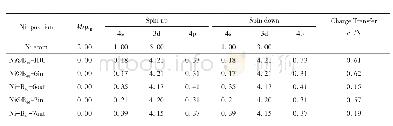
《表3 金属离子的电荷密度》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《应用量子化学计算方法研究大黄素与金属离子的配位作用》
一般来说,金属离子的配位能力与其电荷密度密切相关。电荷密度公式为:ne/4πr3,其中n是金属离子所带的电荷数,e是1个电子所带的电量值(1.60*10-19C),r是金属离子半径。由表3可知,Al3+、Fe3+、Cu2+、Fe2+的电荷密度分别为:364、232、116、98 C·m-3。根据电荷密度,可以推测出金属离子与大黄素配位时,配位能力由大到小依次是:Al3+>Fe3+>Cu2+>Fe2+。需要指出的是,在大黄素与金属离子以2∶1配比所形成的配合物中,只有大黄素铁(Fe2+)的配位数是2,其余三种配合物的配位数均为4(如图2.5-2.8所示),推测这与Fe2+电荷密度较低有关。
| 图表编号 | XD00170251400 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.03.31 |
| 作者 | 韩冬月、宋玲玲、关君 |
| 绘制单位 | 北京中医药大学中药学院、北京中医药大学中药学院、北京中医药大学中药学院 |
| 更多格式 | 高清、无水印(增值服务) |