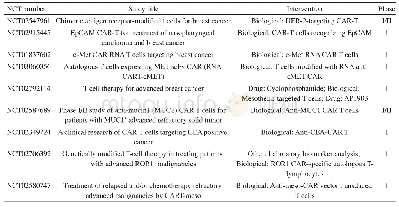
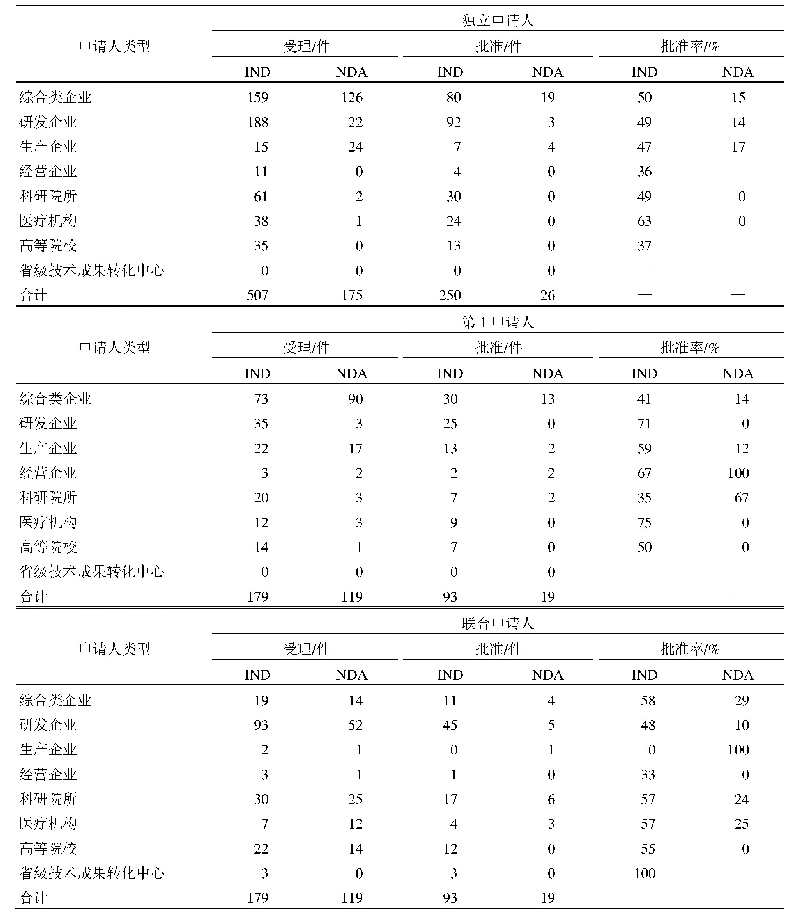
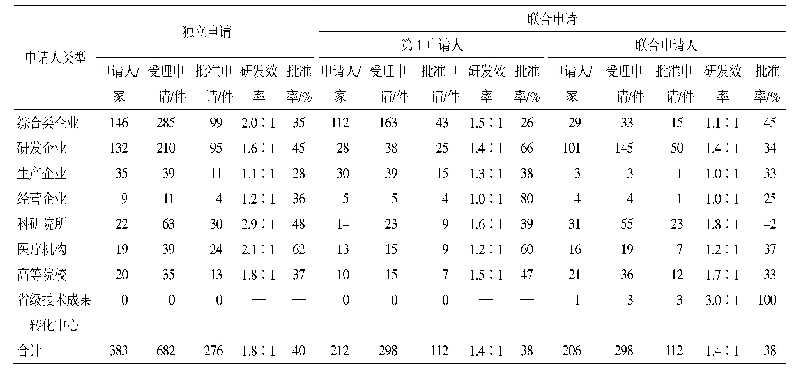
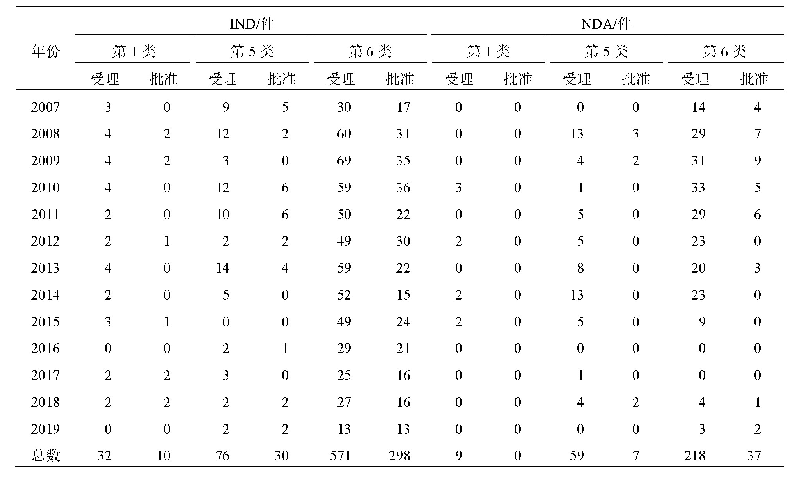
《表1 我国CAR-T细胞治疗产品临床研究申请受理和批准情况a)》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《嵌合抗原受体T细胞治疗产品及其企业GMP实施现状》
注:a)资料来源于CDE和各企业官网;b)按“进口”类别申请
随着技术成熟和资本涌入,目前我国CAR-T细胞治疗产品研发已进入到一个快速发展的阶段。截至2020年2月20日,国家药品审评中心(Center for Drug Evaluation,CDE)共受理了来自26个申请人/联合申请人的40项CAR-T细胞治疗产品的临床研究申请,除了国内企业独立研发的品种外,还有通过合资或进口方式申请的已获美国FDA批准的2种品种,40项申请中已有21项获准开展临床试验(表1)。所有申请的CAR-T细胞治疗产品均为自体回输制剂,适应证以治疗B细胞抗原CD19或B细胞成熟抗原(B cell maturation antigen,BCMA)阳性的血液系统肿瘤为主(表2),所用CAR-T细胞分子载体工艺则包括慢病毒、反转录病毒感染表达和质粒直接转染表达等。与传统药物研发需要经历大规模、长时间的临床试验不同,CAR-T细胞治疗产品的临床研究设计往往更为灵活,为期较短。随着临床试验项目的快速推进,国内个别品种即将进入报产上市阶段。对任何药品研发企业来说,能否顺利获得药品生产许可和通过药品上市前的药品GMP检查至关重要,这也是许多CAR-T细胞治疗产品研发企业眼下必须考虑的问题。本文综合我们已进行的针对CAR-T细胞治疗产品的药品注册现场检查、生产许可现场检查以及对部分企业的现场调研和参观情况,梳理企业存在的常见的药品GMP问题,供业界参考。
| 图表编号 | XD00155376000 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.08.10 |
| 作者 | 谭建新、于玲莉、王冲 |
| 绘制单位 | 上海药品审评核查中心、上海药品审评核查中心、上海药品审评核查中心 |
| 更多格式 | 高清、无水印(增值服务) |