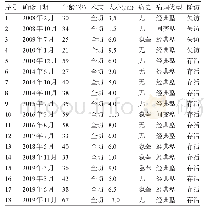
《表2 精原干细胞介导的转基因动物模型》
1994年,Sato等[34]首次将pSV2-cat质粒注入小鼠睾丸,经检测发现附睾中的精子携带了目的基因,但将这些精子显微注射到卵子中,在1细胞的胚胎中并没有显示存在转基因的证据。2001年,Nagano等[35]利用逆转录病毒体外转染小鼠SSCs,获得阳性转基因后代。然而,研究发现,逆转录病毒可以转染几种类型的干细胞,如胚胎干细胞或造血干细胞等,但转入的外源基因的表达通常会减弱或沉默[36-38]。逆转录病毒在体外转染小鼠SSCs的整合效率和表达率很低[35]。2007年,Takehashi等[39]利用ROSA26启动子制备的腺病毒转染小鼠SSCs,从而获得了阳性转基因后代,但高浓度的腺病毒会影响SSCs的增殖速率。2005年,Kanatsu-Shinohara等[40]首次利用慢病毒修饰体外培养的SSCs并将其移植到受体小鼠后获得转基因后代。2014年,Casimir[41]以小鼠精子为转染目标,利用慢病毒介导产生转基因后代。2019年,Bang等[42]通过增强型绿色荧光蛋白为载体的慢病毒体内转染大鼠的SSCs,从而获得了转基因阳性后代。2017年,中科院昆明动物所郑萍团队利用慢病毒体外转染树鼩SSCs,获得转基因后代[11]。2010年,Shen等[43]利用DMSO介导质粒对兔子的生精细胞进行体内转染,从而获得阳性转基因后代。早在1999年,Farre等[44]利用腺病毒体外转染猪SSCs获得了阳性转基因后代。慢病毒介导的基因编辑目前在大动物的相关报道很少,主要是由于大动物SSCs体外培养条件不完善,不能长期增殖。慢病毒介导的转基因方法只能完成外源基因的过表达操作,还受限于病毒的接种时间,而且还需考虑病毒的嗜亲性、滴度、注射剂量以及启动子的构建。2015年,Chapman等[5]使用CRISPR/Cas9在大鼠SSCs中突变Epsti1和Erbb3基因,利用CRISPR/Cas9修饰的精原细胞在大鼠睾丸移植后再生精子,显示出长期形成精子的潜力并产生了非嵌合突变后代。在非人灵长类上,研究人员利用CRISPR/Cas9技术获得了携带多个基因突变的基因编辑食蟹猴,这是首次利用此技术实现了对非人灵长类进行精准的基因编辑[45]。这些研究为利用SSCs创制靶向基因编辑灵长类动物模型奠定了基础,在不久的将来有可能实现利用CRISPR/Cas9技术介导SSCs来创制靶向基因编辑的大动物模型。目前,通过精原干细胞或精子介导的转基因动物模型汇总见表2。
| 图表编号 | XD00154470700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.07.01 |
| 作者 | 王胜男、司维 |
| 绘制单位 | 昆明理工大学灵长类转化医学研究院、昆明理工大学灵长类转化医学研究院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式