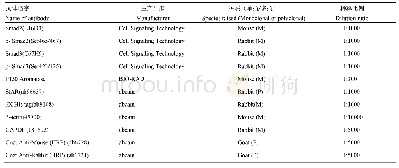
《表1 不同方法表达的重组sll1981蛋白活性比较》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《集胞藻PCC6803中α-酮戊二酸脱羧酶的原核表达分析》
由于sll1981蛋白非常不稳定,经IPTG诱导表达的sll1981蛋白在用咪唑梯度洗脱时已经形成白色沉淀,因此无法检测其催化活性。其他方法纯化得到的sll1981蛋白均能检测出α-KGD活性(表1)。研究结果表明催化活性最高的sll1981蛋白是采用与pTf16质粒共表达的Co-sll1981蛋白,其次为Auto-sll1981蛋白,活性最低的是TF-sll1981蛋白。当TF-sll1981蛋白的TF标签被酶切后,尽管笔者可以纯化得到不带TF标签的sll1981蛋白,然而在测定活性的缓冲液体系中该不带TF标签的sll1981蛋白极易沉淀,因此无法测定其催化活性。当底物α-KG浓度超过6 mmol/L时,采用自诱导方式获得的Auto-sll1981在活性测定缓冲体系中也易沉淀,因此本试验仅能测定其在底物浓度为6 mmol/L时的反应速度为0.670μmol/(L·s),无法测得其他动力学参数。
| 图表编号 | XD00150515400 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.06.20 |
| 作者 | 张伟、刘志文、王小琴、李至敏、谢琮琮、李志敏 |
| 绘制单位 | 江西农业大学生物科学与工程学院、江西农业大学生物科学与工程学院、江西农业大学生物科学与工程学院、江西农业大学理学院、江西农业大学生物科学与工程学院、江西农业大学生物科学与工程学院 |
| 更多格式 | 高清、无水印(增值服务) |