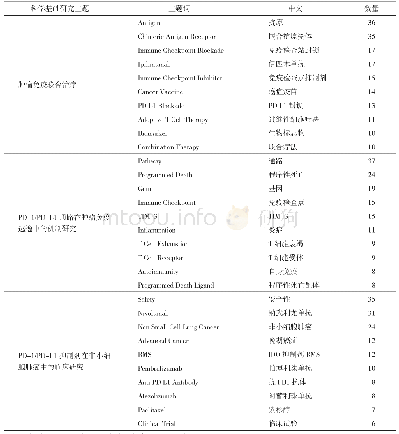
《表1 目前FDA批准的PD-1/PD-L1抑制剂及其适应证》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《PD-1/PD-L1抑制剂在恶性黑色素瘤(新)辅助治疗中的研究进展》
PD-1/PD-L1抑制剂的根本目的在于阻断PD-1与PD/L1的结合,阻断负向调控机制,重新激活T细胞对肿瘤的免疫应答效应从而达到抗肿瘤的作用。2014年美国食品及药物管理局先后批准了PD-1抑制剂Nivolumab(OPDIVO,BMS)和Pembrolizumab(Keytruda,MSD)用于晚期不可切除或转移性恶性黑色素瘤的治疗。短短几年内,FDA批准了包括Atezolizumab(Tecentriq)、Avelumab(Bavencio)、Durvalumab(Imfinzi)在内的6种PD-1/PD-L1抑制剂上市并用于黑色素瘤、非小细胞肺癌、膀胱上皮癌、淋巴瘤等实体肿瘤的治疗及临床研究,见表1。一项Ⅲ期临床研究CheckMate 066[20]共招募418名未经治疗的BRAF野生型晚期恶性黑色素瘤患者,比较Nivolumab(3 mg/kg,每2周一次)与传统化疗药物达卡巴嗪(1 000 mg/m2,每3周一次)的疗效与安全性,结果显示Nivolumab组中位PFS(5.1月vs.2.2月,HR=0.43)、1年生存率(72.9%vs.42.1%,H R=0.4 2)以及客观缓解率(4 0%v s.1 3.9%,OR=4.06)都显著优于达卡巴嗪组,同时3~4级不良反应发生率(11.7%vs.17.6%)更低。另一项针对Pembrolizumab的Ⅱ期随机对照临床研究KEY-NOTE-002[21]共纳入了540例晚期Ipilimumab耐药黑色素瘤患者,随机分为Pembrolizumab 2 mg/kg,每3周一次或Pembrolizumab 10 mg/kg,每3周一次及传统化疗组,中位随访时间28月,结果显示与传统化疗组相比Pembrolizumab组虽然没有总生存时间的显著延长,但无进展生存期和客观缓解率等都有显著提高。PFS分别为34%(Pembrolizumab2 mg/kg,HR=0.57)、38%(Pembrolizumab 10 mg/kg,HR=0.50)和16%(化疗组)。同时3~4级不良反应发生率也更低(13.5%vs.16.8%vs.26.3%)。在另一项Ⅲ期随机对照KEYNOTE-006[22]研究中,Pembrolizumab(10 mg/kg,每2周一次或每3周一次)与Ipilimumab对照组晚期黑色素瘤患者的PFS和OS均有显著提高。
| 图表编号 | XD00142447900 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.02.25 |
| 作者 | 邹瀚辉、李涛 |
| 绘制单位 | 中国科学院大学附属肿瘤医院骨与软组织肿瘤外科、中国科学院大学附属肿瘤医院骨与软组织肿瘤外科 |
| 更多格式 | 高清、无水印(增值服务) |