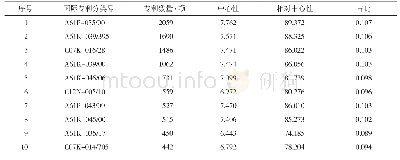
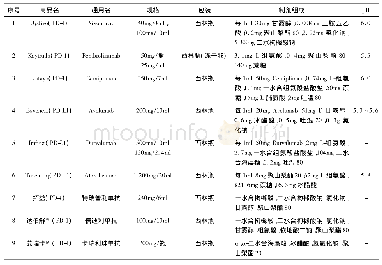
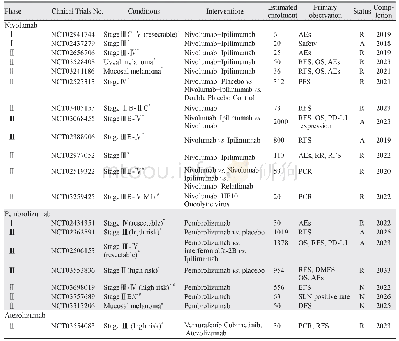
《表2 PD-1/PD-L1抑制剂相关黑色素瘤(新)辅助治疗临床研究汇总》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《PD-1/PD-L1抑制剂在恶性黑色素瘤(新)辅助治疗中的研究进展》
抗PD-1抑制剂Nivolumab(OPDIVO,BMS-936558,ONO-4538,MDX-1106)是全人源化免疫球蛋白G4蛋白单克隆单克隆抗体,最早开展于2015年3月的CheckMate-238[23]临床研究为随机对照双盲Ⅲ期临床试验,对比Nivolumab(3 mg/kg,每2周一次)与Ipilimumab组(10mg/kg,每3周一次,4周期)在可切除的ⅢB/C期或Ⅳ期黑色素瘤术后辅助治疗中的疗效。研究共纳入了906名患者,按1:1进行配对,结果显示Nivolumab组的12月无复发生存率RFS为70.5%(95%CI:66.1~74.5),Ipilimumab组为60.8%(95%CI:56.0~65.2),风险比HR=0.65(97.56%CI:0.51~0.83),P<0.001。分层研究后发现,在PD-L1表达水平<5%的患者中,Nivolumab组和Ipilimumab组无复发生存率(RFS)分别为64.3%和53.7%,HR=0.71(95%CI:0.56~0.91);在PD-L1表达水平>5%的患者中,Nivolumab组和Ipilimumab组RFS分别为81.9%和73.8%,HR=0.5(95%CI:0.32~0.78)。3~4级不良反应发生率Nivolumab组为14.4%vs.Ipilimumab组45.9%,因为不良事件导致的治疗中断率Nivolumab组为9.7%vs.Ipilimumab组为42.6%。Ipilimumab组有2例因药物不良反应死亡的案例。在另一项Ⅱ期临床试验BrUOG-324中,研究者观察25例Ⅲ/Ⅳ期可切除的黑色素瘤患者接受Nivolumab(3 mg/kg,每2周一次)加小剂量Ipilimumab(1 mg/kg,每6周一次)术后辅助治疗的不良反应和RFS,初步的结论发现3~4级化疗相关不良反应发生率为35%(NCT02656706)。去年,一项大型随机、对照、双盲、多中心的Ⅲ期临床研究研究已经启动(CheckMate 915),研究计划纳入2 000名完全切除原发病灶的ⅢB~Ⅳ期恶性黑色素瘤患者,对比Nivolumab联合Ipilimumab与Nivolumab单用的疗效评估,主要研究终点为RFS,次要研究终点为OS和PD-L1的表达情况,研究预计将在2020年结束(NCT03068455)。此外,还有多项Nivolumab单药或联合Ipilimumab等其他药物的Ⅱ/Ⅲ期临床研究正在进行,见表2。
| 图表编号 | XD00142448000 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.02.25 |
| 作者 | 邹瀚辉、李涛 |
| 绘制单位 | 中国科学院大学附属肿瘤医院骨与软组织肿瘤外科、中国科学院大学附属肿瘤医院骨与软组织肿瘤外科 |
| 更多格式 | 高清、无水印(增值服务) |