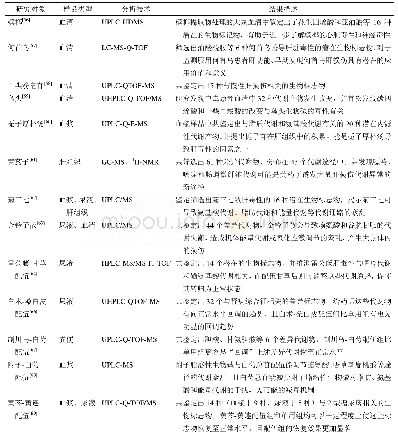
《表1 多组学整合技术在肿瘤中的应用及其意义》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《组学技术在肿瘤精准诊疗中应用的研究进展:从单组学分析到多组学整合》
N:肿瘤样本;n:正常样本
整合多组学策略在肿瘤研究中得到了广泛的应用(表1)。目前的研究主要集中在以下几个方面:(1)对肿瘤发生、侵袭和转移,多组学的整合可以更加系统地揭示肿瘤发生发展的具体机制。传统概念中,DNA或m RNA表达水平即可代表蛋白质水平,然而,ZHANG等[44]首次提出m RNA并不能准确地预测蛋白质丰度的变化,基因产物的生物学功能以及m RNA和蛋白质的稳定性都间接影响着m RNA与蛋白质的相关性。在结直肠癌中,大多数CNAs会促进m RNA丰度改变,但对蛋白质丰度的影响却甚小。该研究通过整合基因组学和蛋白质组学对96例结直肠癌组织进行分析,揭示了20q染色体扩增的重要性,并发现肝细胞核因子4α在癌细胞的增殖过程中具有重要意义。同样,LI等[45]对11例不同类型肺癌组织进行多组学分析后,发现丝氨酸羟甲基转移酶2在非小细胞肺癌中表达上调,并与染色体12q14.1位点扩增相关,同时丝氨酸羟甲基转移酶2也与肺腺癌的转移及不良预后相关。(2)明确肿瘤分型。与通过单一组学对肿瘤进行分层相比,多组学分析可以系统地提供分型依据,从而为指导精准治疗提供可靠依据。例如,单组学分析早已证实BAP1失活是间皮瘤的关键影响因素。SHRESTHA等[46]综合分析19例恶性腹膜间皮瘤(ma‐lignant peritoneal mesothelioma,Pe M)的基因组、转录组和蛋白质组,结果发现BAP1基因单倍体缺失(BAP1del)是一种独特的分子亚型,与染色质重塑、DNA修复、免疫检查点激活、炎性肿瘤微环境等密切相关。即多组学整合分析结果系统全面地证实了BAP1可用于改善Pe M分型和指导患者治疗。另有研究[47]对睾丸生殖细胞肿瘤进行综合多组学分析,发现KIT基因突变可将该肿瘤中的精原细胞瘤亚型识别出来,进而为治疗提供参考。(3)识别特异性标志物。CHEN等[48]对38组口腔鳞状细胞癌和对照组的组织标本进行DNA、RNA和蛋白质不同水平上的分析,发现基因APO‐BEC3突变与患者的生存率相关。另外,为了阐明卵巢癌的特异性标志物和详尽的发生机制,ZHANG等[49]对TCGA分析的174例卵巢癌标本进一步进行了基于质谱的蛋白质组学分析,结果显示蛋白质表达水平与染色质不稳定性、基因组重排和短期生存率密切相关,转录因子SRF和血管生成相关的信号通路PDGFR-beta可能是卵巢癌潜在的预后标志物。在蛋白质翻译后修饰水平,该研究[49]证实组蛋白H4的K12和K16位点乙酰化为分层治疗患者提供了一种潜在的方法,PDGFR通路的激活与较差的临床预后相关。(4)探索潜在治疗靶点。为了攻克肿瘤,多组学整合策略也为发现潜在药物靶点提供理论依据。ITKONEN等[50]结合转录组学、蛋白质组学和代谢组学对前列腺癌细胞进行综合分析,发现细胞周期蛋白依赖性激酶9(cyclin-dependent kinase-9,CDK9)抑制剂导致转录水平下降,从而降低了半衰期,且与癌细胞快速增殖相关的m RNA相关,较长时间抑制CDK9可诱导前列腺癌细胞的急性代谢应激,导致酰基-肉碱和脂肪酸氧化中的代谢中间体的积累而改变肿瘤代谢,这一研究说明CDK9可成为肿瘤的潜在治疗靶点。以上研究证明,多组学整合分析能够更加准确地揭示肿瘤分子特征,有助于识别肿瘤特异性生物标志物,实现对肿瘤的早期分层,为肿瘤的精准化和个体化治疗提供重要依据。
| 图表编号 | XD00128421300 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.12.25 |
| 作者 | 冉冰冰、梁楠、孙辉 |
| 绘制单位 | 吉林大学中日联谊医院甲状腺外科吉林省外科转化医学重点实验室吉林省甲状腺疾病防治工程实验室、吉林大学中日联谊医院甲状腺外科吉林省外科转化医学重点实验室吉林省甲状腺疾病防治工程实验室、吉林大学中日联谊医院甲状腺外科吉林省外科转化医学重点实验室吉林省甲状腺疾病防治工程实验室 |
| 更多格式 | 高清、无水印(增值服务) |