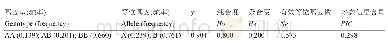《表1 CD 40基因3’-UTR与hsa-mi R-103a-3p的结合位点预测》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《基于生物信息学分析miRNA-103a-3p在子宫内膜癌中表达及临床意义》
为进一步查明miR-103a-3p表达异常参与EC疾病进程的分子机制,本研究利用生物信息学方法筛选靶基因库中潜在功能分子。通过miRWalk 2.0筛选构建了miR-103a-3p的靶基因集,将预测所得与实验验证的靶基因集整合,共得到1670个靶基因集,其中交集基因131个。随后对1670靶基因集进行GO功能富集分析,结果显示miR-103a-3p可能通过调控蛋白质结合、细胞质、细胞质基质、细胞膜、核质、ATP结合等生物学过程或细胞结构参与EC疾病进程。另外,KEGG通路富集分析显示miR-103a-3p可能通过调控AMPK、Hippo、干细胞多能性调节、磷脂酰肌醇信号系统通路等发挥生物学功能。已有的研究表明AMPK信号通路广泛参与了机体细胞能量代谢调节[18]、肿瘤细胞增殖与凋亡调控[19]等。Hippo信号通路则主要通过其效应分子YAP(Yes-associated protein)的异常活化参与包括EC在内的多种肿瘤发生发展[20]。进一步证实miR-103a-3p异常表达参与了EC的疾病进程。另外,通过蛋白互作分析筛选出的10个核心基因中仅CD40的mRNA表达在EC组织中降低,并且Kaplan-Meier分析CD40表达水平高的患者总体生存时间更长。CD40最早由Paulie在膀胱癌细胞中发现,是一种与T细胞和B细胞功能相关的表面抗原,主要通过CD40/CD40L途径参与机体免疫、炎症、止血、肿瘤发生发展过程[21]。而已有研究发现miRNAs通过靶向调控CD40表达参与肿瘤进程,如高转移性胰管腺癌中高表达的miR-224和miR-486通过靶向抑制CD40表达参与调控肿瘤进程[22]。本研究通过数据库预测到miR-103a-3p与CD 40存在靶向调控关系(表1),结合PPI核心蛋白分析结果推测miR-103a-3p参与EC的疾病进程可能与其对核心蛋白CD 40靶向调控相关。
| 图表编号 | XD00121061400 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.12.20 |
| 作者 | 周登莲、刘晓岚、邓鑫 |
| 绘制单位 | 西南医科大学教务处、西南医科大学、西南医科大学药物与功能性食品研究中心 |
| 更多格式 | 高清、无水印(增值服务) |
![表3 CD157/BST1基因位点rs4301112基因型分布与ASD严重程度关系[n(%)]](http://bookimg.mtoou.info/tubiao/gif/SDJB202003011_02100.gif)