《表1 复合材料中桑蚕丝素蛋白各组分含量》
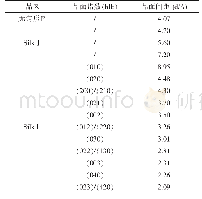
图2是不同质量比例丝素蛋白与聚乳酸复合材料在2000~800 cm-1范围的FTIR谱图。1752 cm-1处的吸收峰为PLA分子链上C=O的特征吸收,由于C=O基团极性较大,在振动过程中的偶极矩变化幅度也较大,其特征吸收为强吸收峰。1447 cm-1峰属于C—H的变形振动。1358 cm-1附近的峰为甲基振动吸收峰,1186 cm-1和1092 cm-1的峰属C—O伸展振动[15]。丝素蛋白在酰胺Ⅰ区的红外特征峰出现在1645 cm-1,在酰胺Ⅱ区的红外特征峰出现在1541 cm-1处。随着丝素蛋白在复合材料中的比例增加,复合材料在1752、1186和1092cm-1处的聚乳酸的吸收峰强度逐渐衰弱并消失;归属于丝素在1645和1541 cm-1处的红外特征峰逐渐变大。当丝素蛋白与聚乳酸的共混比例为5∶1、5∶5、1∶5时,在1645和1541 cm-1处红外特征峰分别向1623和1524 cm-1处发生了偏移,这是由于电子接受体的s轨道与电子给体的p轨道发生有效重叠时形成相互作用,改变了原来化学键的力常数,因而使得吸收峰位置发生变化。就复合膜而言,聚乳酸分子链上的C O与丝素上的N—H形成氢键作用,导致电荷从C O双键离域到其他原子上,使C O的双键性降低,从而吸收频率下降,C O特征峰向低波方向位移[16]。为了探究复合膜中丝素与聚乳酸分子间相互作用时各结构比例的变化,对丝素酰胺Ⅰ区1750~1580 cm-1红外光谱进行高斯拟合,结果列于表1。从表1中可以看出纯丝素膜(MSF/PLA-5:0)的二级结构中β-折叠的含量为23.29%,无规卷曲和α-螺旋的含量为66.80%,故可以认为纯丝素蛋白膜含有较多无规卷曲结构,与文献报道结果[17-18]一致。而随着PLA在复合材料中比例的增加,丝素蛋白中的β-折叠的含量由23.29%降低到12.23%,无规卷曲和α-螺旋的含量由66.80%增加到73.89%,转角含量由8.55%增加到12.56%。Hu等[19]认为丝蛋白中的β-折叠体对于促进蛋白质分子的稳定和不溶性结构的形成是重要的。而在本实验的红外结果分析中丝素蛋白中的β-折叠的含量随着聚乳酸的增加而降低,表明聚乳酸的加入部分地破坏了丝素蛋白分子中β-折叠晶体中氢键,而与丝素上的N—H形成了新的氢键作用,这与前期研究结果相一致[20]。同时,丝素蛋白的疏水基团也会与聚乳酸链段产生静电作用与疏水作用[18,20]。
| 图表编号 | XD00118124200 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.01.01 |
| 作者 | 李莹莹、邓谦谦、刘浩、刘其春、顾正桂、王昉 |
| 绘制单位 | 南京师范大学分析测试中心、南京师范大学化学与材料科学学院、南京师范大学分析测试中心、南京师范大学化学与材料科学学院、南京师范大学分析测试中心、南京师范大学化学与材料科学学院、南京师范大学分析测试中心、南京师范大学化学与材料科学学院、南京师范大学化学与材料科学学院、南京师范大学分析测试中心 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式