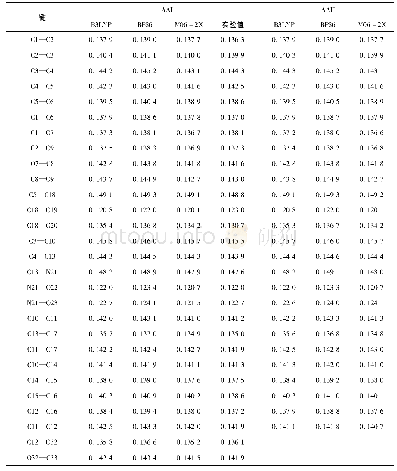
《表5 在M06-2X/6-311G(d,p)水平下优化得到[HHex][TFS]-n H2O分子间的相互作用BCPs的电子密度(kcalmol-1)》
![《表5 在M06-2X/6-311G(d,p)水平下优化得到[HHex][TFS]-n H2O分子间的相互作用BCPs的电子密度(kcalmol-1)》](http://bookimg.mtoou.info/tubiao/gif/HGSZ2019S2015_03600.gif) 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《己基乙二胺-TFS型质子化离子液体与水分子间氢键相互作用的研究》
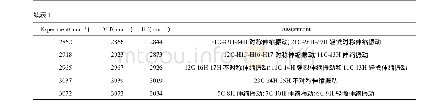
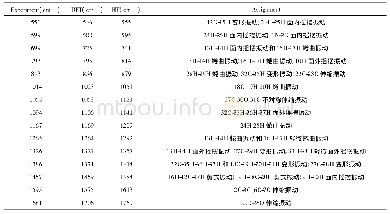
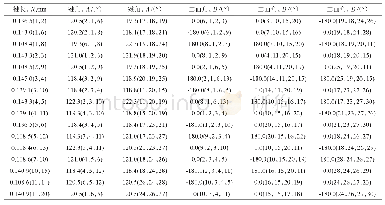
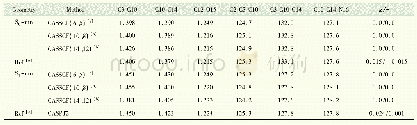
AIM理论是一种判断氢键存在及其强弱的重要方法。对分子结构的键临界点(bond critical point,BCP)的电子密度(ρc)及Laplace值(?2ρc)的拓扑分析,可以定性地鉴定[HHex][TFS]与n H2O相互作用的本质。ρc值可以判断化学键的强弱,ρc值越小,表明化学键越弱;ρc值越大,表明化学键越强。?2ρc表示Laplace值,是ρc的二阶导数,通过?2ρc的正负可以判断键的性质。若?2ρc>0,化学键所显现的离子性越强;若?2ρc<0,化学键所显现的共价性越强[24]。从表5可以看出,氢键作用的ρc值(9.61~47.77 kcal·mol-1大多数大于典型氢键的ρc值(ρ=1.25~20.09 kcal·mol-1),这说明[HHex][TFS]与n H2O间形成较强的氢键作用[30]。[HHex][TFS]-n H2O较稳定构型的?2ρc值在33.84~100.18 kcal·mol-1之间,均大于等于典型氢键(?2ρc=12.54~87.17 kcal·mol-1),说明形成较强的氢键作用。ρc、?2ρc、ρc(sum)(分子中ρc之和)、Lagrange动能(G(r))、Hamilton动能(H(r))及势能密度(V(r))如表5所示。结果显示,[HHex][TFS]-H2O(S1~S4)分子间形成N—H···O型氢键:S4(ρc(sum)=71.20 kcal·mol-1)>S3(ρc(sum)=53.24 kcal·mol-1)>S1(ρc(sum)=53.20 kcal·mol-1)>S2(ρc(sum)=24.86 kcal·mol-1),S4中氢键作用最强,构型最稳定。[HHex][TFS]-2H2O(S5~S7)分子间形成N—H···O、N···O—H及O···O—H型氢键,ρc(sum)值呈现以下趋势:S6(ρc(sum)=93.03 kcal·mol-1)>S7(ρc(sum)=67.42 kcal·mol-1)>S5(ρc(sum)=36.26 kcal·mol-1),S6中氢键作用最强,构型最稳定。[HHex][TFS]-6H2O(S8)分子间同样形成N—H···O、N···O—H及O—H···O型氢键:S8(ρc(sum)=184.83 kcal·mol-1)。可以看出,随着[HHex][TFS]与H2O结合数量增加,氢键相互作用增强。
| 图表编号 | XD00118094100 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.09.01 |
| 作者 | 郑勋、徐宇、花儿 |
| 绘制单位 | 北方民族大学化学与化学工程学院、北方民族大学化学与化学工程学院、北方民族大学化学与化学工程学院、北方民族大学国家民委化工技术基础重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |