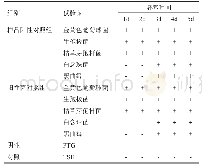
《表4 无菌产品:无菌检查要点》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《医疗器械生产质量管理体系中微生物检验方面的监管研究》
依据以上定义,对于高风险医疗器械生产企业,在以下几种情况下需要进行相关微生物检验,分别是厂房或检验室有洁净度要求时、生产工艺中使用纯化水或注射用水时、非无菌产品出厂前对初始污染菌的控制水平有要求时、以及无菌产品出厂前需要进行无菌检验时。按照法定的方法和标准进行检验对于确保医疗器械产品的质量和使用安全是十分重要的。以下分别对当前医疗器械生产企业普遍引用的微生物检验要点进行了归纳(参见表1~4)。从中可以看出,生产企业应根据不同的检查对象,选择最适宜且符合标准的检测方法和指标,监管人员在现场检查时,也应熟知每种检验的具体要求,尤其是应检查培养基的种类、主要检验仪器和试剂的配制、对照试验、培养基适用性检查等。
| 图表编号 | XD0097341700 严禁用于非法目的 |
|---|---|
| 绘制时间 | |
| 作者 | 唐剑、姚鹏 |
| 绘制单位 | 厦门市食品药品审评认证与不良反应监测中心 |
| 更多格式 | 高清、无水印(增值服务) |